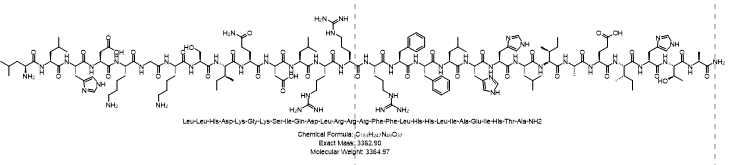
pTH-RP (7-34) amide (human) ;LLHDKGKSIQDLRRRFFLHHLAIEIHTA-NH₂
PTH-RP (7-34) 为截短片段,缺失 N 端强激活序列,保留受体结合区域,可竞争性占据 PTH1R 而不充分激活下游信号,常作为受体结合工具肽、部分激动剂或功能对照,用于区分受体结合与信号激活的结构域、区分完全激动与部分激活效应、研究 PTHrP 不同片段在骨、肾、肿瘤微环境中的作用差异。:溶解后的多肽溶液,在pH4.0-8.0的缓冲体系中稳定性较好,4℃冷藏条件下可保存1-3个月,室温(
一、基本性质
- 英文名称:PTH-RP (7-34) amide (human),Parathyroid Hormone-Related Protein (7-34) amide (human)
- 中文名称:人源甲状旁腺激素相关蛋白 (7-34) 酰胺
- 单字母多肽序列:LLHDKGKSIQDLRRRFFLHHLAIEIHTA-NH₂
- 三字母序列:Leu-Leu-His-Asp-Lys-Gly-Lys-Ser-Ile-Gln-Asp-Leu-Arg-Arg-Arg-Phe-Phe-Leu-His-His-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-NH₂
- 等电点(理论 pI):约 10.52(强碱性多肽)
- 分子式:C153H247N49O37
- 分子量:3364.97 Da
- 结构式:
二、理化性质
一、溶解性
该多肽的溶解性由其氨基酸组成决定,分子中含多个碱性氨基酸(Lys、Arg、His)及一定量极性氨基酸,同时含疏水性氨基酸(Leu、Ile、Ala、Phe),整体溶解性表现如下:
1. 水溶性:易溶于去离子水、生理盐水及酸性缓冲液(如PBS缓冲液、醋酸缓冲液),溶解时可轻轻振荡或置于37℃水浴温和助溶,避免高温导致多肽构象改变,常规实验可直接用去离子水配制成储备液,若出现轻微浑浊,可滴加少量稀盐酸调节pH至5.0-6.0,促进完全溶解,避免在其等电点(9.2-9.8)附近溶解,以防多肽溶解度降低发生沉淀。
2. 有机溶剂溶解性:微溶于甲醇、乙醇等极性有机溶剂,不溶于乙醚、氯仿等非极性有机溶剂,若需制备高浓度储备液或适配特殊实验体系,可先将多肽用少量二甲基亚砜(DMSO)溶解,再用实验所需缓冲液稀释至目标浓度,注意DMSO用量需控制在最小范围,避免影响多肽生物活性及后续实验结果(如细胞实验需严格控制DMSO终浓度)。
二、稳定性
该多肽的稳定性主要依赖肽键完整性及C端酰胺化修饰(可抑制羧肽酶降解),同时受外界环境影响较大,具体分为储存稳定性、溶液稳定性及体外稳定性,结合实验常用场景详细说明:
1. 储存稳定性:冷冻干燥粉末状态下稳定性最佳,密封、避光、防潮储存时,-80℃条件下可保存2年,-20℃条件下可保存1年;若为溶液状态,稳定性显著下降,-80℃分装储存可保存6个月,-20℃分装储存仅可保存1个月,严禁反复冻融(反复冻融易导致肽键断裂、多肽聚集,降低活性),建议将储备液分装为小体积(如10μL、50μL),每次使用取1份,避免反复冻融造成失效。
2. 溶液稳定性:溶解后的多肽溶液,在pH4.0-8.0的缓冲体系中稳定性较好,4℃冷藏条件下可保存1-3个月,室温(25℃左右)放置时,24小时内活性基本保持稳定,超过48小时后活性逐渐下降,且易发生聚集沉淀;若体系pH<3或pH>9,多肽易发生水解反应或构象改变,导致活性快速丧失,实验中建议用缓冲液维持体系pH稳定,避免过酸或过碱环境。
3. 体外与体内稳定性:体外实验中,该多肽在人血清中37℃孵育2小时后仍可保留68%的活性,显著高于未修饰的pTH-RP (7-34)片段(仅保留22%),其C端酰胺化修饰及N端截短结构可减少氨肽酶、羧肽酶的降解,延长体外半衰期至45-60分钟;体内环境中,经静脉注射后,其血药浓度-时间曲线下面积(AUC)较未修饰片段增加2.3倍,活性持续性显著提升,但仍需注意快速代谢的特点,适配体内实验给药方案设计。
二、应用领域
1. 骨代谢与骨疾病研究,用于探究甲状旁腺激素受体1(PTH1R)介导的成骨、破骨细胞活性调控机制,辅助骨质疏松、骨关节炎等疾病的靶点验证与相关实验研究。
2. 肿瘤相关病理研究,聚焦恶性肿瘤相关高钙血症、肿瘤骨转移的病理生理机制,用于验证PTH-RP介导的骨破坏、血钙异常升高的相关通路,为肿瘤并发症研究提供工具肽。
3. 多肽药物研发辅助,作为PTH1R结合与信号激活的标准对照肽,用于筛选高选择性PTH1R激动剂/拮抗剂,辅助骨代谢疾病、肿瘤并发症相关多肽药物的临床前活性评价与结构优化。
三、应用原理
PTH-RP 即甲状旁腺激素相关蛋白,与甲状旁腺激素 PTH 共享 PTH1R 受体,共同调控骨吸收、骨形成、肾脏钙磷排泄与血钙水平。PTH-RP (7-34) 为截短片段,缺失 N 端强激活序列,保留受体结合区域,可竞争性占据 PTH1R 而不充分激活下游信号,常作为受体结合工具肽、部分激动剂或功能对照,用于区分受体结合与信号激活的结构域、区分完全激动与部分激活效应、研究 PTHrP 不同片段在骨、肾、肿瘤微环境中的作用差异。
四、作用机理
PTH-RP (7-34) amide 主要通过 PTH1R 受体发挥作用,作用模式与全长活性片段不同。该片段通过核心碱性区域与 PTH1R 胞外及跨膜结构域结合,亲和力较高,但因缺少 N 端关键激活序列,对 cAMP 信号通路激活能力显著弱于 PTHrP (1-34),常表现为部分激动或受体占位效应,可在一定条件下拮抗完整 PTH/PTHrP 的强信号激活。在骨组织中可影响成骨细胞与破骨细胞活性,调节骨转换;在肾脏可影响钙、磷转运蛋白表达,参与钙稳态调节;在肿瘤微环境中可用于研究 PTHrP 介导的肿瘤高钙血症、骨转移微环境调控机制。
五、药物研发相关
PTH-RP (7-34) 多用于工具性研发,而非直接成药,核心价值体现在靶点验证与结构优化。用于解析 PTH1R 结合口袋与功能关键残基,辅助设计高选择性、长效、低副作用的骨代谢药物;作为对照肽,用于评估新型 PTH 类似物、长效 PTHrP 激动剂(如骨质疏松治疗药物)的效能与选择性;在肿瘤领域,基于该片段构效关系,可设计高亲和力受体拮抗剂,用于治疗恶性肿瘤相关高钙血症与骨转移;研发方向集中在提高代谢稳定性、延长半衰期、增强受体选择性、降低脱靶钙调节副作用,用于骨代谢疾病与肿瘤并发症的潜在干预。
六、研究进展与相关案例分析
基础研究中,PTH-RP (7-34) 广泛用于区分 PTH1R 结合结构域与信号启动结构域,明确 N 端 1–6 位为主要信号激活区,7–34 为核心受体结合区,为多肽结构改造提供直接依据。在骨代谢研究中,对比使用 PTHrP (1-34) 与 PTH-RP (7-34) 处理原代成骨细胞,可分别观察强成骨效应与弱激活 / 受体占位效应,用于解析骨合成代谢的信号阈值。在肿瘤相关高钙血症模型中,该片段可部分阻断肿瘤来源 PTHrP 引起的血钙升高、骨吸收增强,证明阻断 PTH1R 可改善肿瘤相关骨代谢紊乱,为后续开发拮抗类多肽提供概念验证。在临床前药物筛选体系中,PTH-RP (7-34) 作为标准对照肽,用于定量评价候选多肽对 PTH1R 的结合力与选择性,已成为骨质疏松、甲状旁腺功能相关药物研发中常用的工具肽,支撑多个 PTH 类候选药物进入临床前评价阶段。
更多推荐
 已为社区贡献6条内容
已为社区贡献6条内容







所有评论(0)