FITC/Cy3/Cy5/Cy7/罗丹明修饰Beta Amyloid 25-39;GSNKGAIIGLMVGGV
Aβ25-39 的聚集过程复杂,且血脑屏障的通透性限制了多数药物的脑部递送效率;同时,该片段的神经毒性涉及多通路调控,单一靶点药物的疗效有限。
·
基本信息
- 英文名称:Beta Amyloid 25-39;Amyloid-β (25-39)
- 中文名称:β- 淀粉样蛋白 (25-39)
- 氨基酸序列:甘氨酸 - 丝氨酸 - 天冬酰胺 - 赖氨酸 - 甘氨酸 - 丙氨酸 - 异亮氨酸 - 异亮氨酸 - 甘氨酸 - 亮氨酸 - 甲硫氨酸 - 缬氨酸 - 甘氨酸 - 甘氨酸 - 缬氨酸
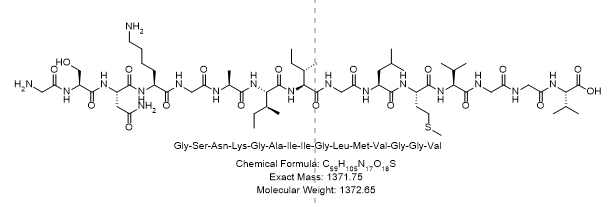
- 单字母序列:GSNKGAIIGLMVGGV
- 三字母序列:Gly-Ser-Asn-Lys-Gly-Ala-Ile-Ile-Gly-Leu-Met-Val-Gly-Gly-Val
- 分子量:1372.65Da
- 分子式: C59H105N17O18S
- 等电点:经多肽理化性质分析工具计算,其等电点(pI)约为 9.0(序列中含 1 个赖氨酸碱性氨基酸,酸性氨基酸为 0,整体呈碱性)
- Counter ion:TFA
- 结构式:
应用领域
- 阿尔茨海默病基础研究:作为 β- 淀粉样蛋白的核心毒性片段,用于探究 AD 的病理机制,包括神经元损伤、突触功能障碍、神经炎症等过程的分子机制研究。
- 药物筛选模型构建:用于体外细胞模型和体内动物模型的药物筛选,评估候选药物对 Aβ25-39 聚集的抑制作用及神经毒性的拮抗效果。
- 诊断试剂研发:作为抗原靶点,用于开发检测 Aβ 聚集的抗体或生物传感器,助力 AD 早期诊断技术的研发。
应用原理
- 神经毒性模拟:Aβ25-39 具有与全长 Aβ 类似的疏水性和聚集特性,可在体外诱导神经元凋亡、钙内流异常及氧化应激,模拟 AD 脑内的神经损伤过程。
- 聚集特性应用:该片段易形成寡聚体和纤维状聚集体,可通过检测其聚集程度,评估药物或化合物的抗聚集活性。
- 靶点验证工具:通过干预 Aβ25-39 的产生、聚集或毒性作用,验证其在 AD 病理中的关键作用,为药物靶点的选择提供实验依据。
药物研发
- 研发方向
- 抗聚集药物:设计小分子化合物、多肽或抗体,抑制 Aβ25-39 的聚集,减少寡聚体和纤维的形成。
- 神经保护药物:开发能够拮抗 Aβ25-39 神经毒性的药物,如钙离子通道阻滞剂、抗氧化剂等,减轻神经元损伤。
- 酶调节剂:靶向调控 β- 和 γ- 分泌酶的活性,减少 Aβ25-39 等毒性片段的生成。
2.研发挑战:Aβ25-39 的聚集过程复杂,且血脑屏障的通透性限制了多数药物的脑部递送效率;同时,该片段的神经毒性涉及多通路调控,单一靶点药物的疗效有限。
作用机理
- 神经毒性作用:Aβ25-39 聚集形成的寡聚体可引发神经元内钙离子稳态失衡,导致钙内流异常,激活下游凋亡信号通路;同时诱发氧化应激和线粒体功能障碍,造成神经元能量代谢紊乱,最终导致神经元死亡。
- 炎症反应激活:该片段可激活脑内小胶质细胞,促使其释放白细胞介素 - 6(IL-6)、肿瘤坏死因子 -α(TNF-α)等促炎因子,引发慢性神经炎症,进一步加剧神经元损伤。
- 突触功能干扰:Aβ25-39 寡聚体可结合神经元突触上的 NMDA 受体等靶点,破坏突触的信号传递功能,导致学习和记忆能力下降,这是 AD 认知障碍的重要病理基础。
研究进展
- 机制研究深化:2024-2025 年的研究发现,Aβ25-39 的毒性存在钙非依赖性早期阶段和钙依赖性晚期阶段,早期阶段主要抑制细胞氧化还原系统,晚期则引发细胞坏死,这为分阶段干预 AD 提供了新的理论依据。同时,研究揭示其可通过调控线粒体自噬和富马酸盐代谢通路,在神经元和免疫细胞中产生不同的生物学效应,拓展了对 Aβ 多功能性的认知。
- 干预策略创新:2024 年的研究聚焦于 ** 诱饵肽(decoy peptides)** 的开发,这类由 D - 氨基酸构成的短肽可与 Aβ25-39 结合,阻断其聚集和钙内流效应,在体外实验中已展现出显著的神经保护作用;此外,免疫疗法方向也取得进展,靶向 Aβ25-39 的单克隆抗体在动物模型中可减少脑内 Aβ 沉积,改善认知功能。
- 研究资助与投入:2024 年全球针对 Aβ 相关靶点的研究项目获 8.13 亿美元资助,其中针对 Aβ25-39 等毒性片段的机制研究和药物开发占比约 15%,反映出该领域的科研重视程度与投入规模。
相关案例分析
- 诱饵肽拮抗 Aβ25-39 毒性案例:研究人员构建了由 D - 氨基酸组成的六肽组合文库,筛选出能与 Aβ25-39 特异性结合的诱饵肽。该类肽可与 Aβ25-39 形成复合物,完全阻断其诱导的钙离子内流,在原代海马神经元培养模型中,使 Aβ25-39 导致的神经元凋亡率降低 70% 以上,为多肽类抗 AD 药物研发提供了直接实验依据。
- 钙离子通道阻滞剂干预案例:在 Aβ25-39 诱导的神经元损伤模型中,使用尼卡地平、地尔硫卓等钙离子通道阻滞剂,可显著抑制晚期阶段的乳酸脱氢酶(LDH)释放(细胞死亡标志物),使神经元存活率提升 50%,证实钙信号通路是 Aβ25-39 毒性的关键下游靶点,也验证了钙通道调节剂在 AD 治疗中的潜在价值。
- 线粒体自噬调节剂的应用案例:针对 Aβ25-39 引发的线粒体自噬紊乱,研究人员使用富马酸盐代谢调节剂干预小鼠 AD 模型,可逆转 Aβ25-39 导致的神经元线粒体功能异常,使小鼠的空间记忆能力在水迷宫实验中得到显著改善,该研究为靶向代谢通路治疗 AD 提供了新的实践方向。
更多推荐
 已为社区贡献6条内容
已为社区贡献6条内容








所有评论(0)