【医学影像 AI】基于Radon变换检测血管宽度和角度诊断 ROP 病变
提出了一种基于颞侧血管宽度和角度诊断早产儿视网膜病变(ROP)严重程度的计算机辅助方法。研究发现随着ROP严重程度增加,颞侧动静脉角度(TAA/TVA)显著减小,而血管宽度(TAW/TVW)显著增大。这些特征可为ROP早期诊断提供客观依据,有望辅助临床筛查决策。
更多内容请关注【医学影像 AI by youcans@Xidian 专栏】
【医学影像 AI】基于Radon变换检测血管宽度和角度诊断 ROP 病变
0. 论文简介
0.1 基本信息
2022年 台北 Huang Y-P 等 在 Front Pediatr 发表论文 “通过计算机辅助测量颞侧血管宽度和角度检测 ROP 病变严重程度(Computer-Aided Detection of Retinopathy of Prematurity Severity in Preterm Infants via Measurement of Temporal Vessel Width and Angle)”。
论文下载: Frontiers, PubMed
引用格式: Huang Y-P, Vadloori S, Kang EY-C and Wu W-C (2022) Computer-Aided Detection of Retinopathy of Prematurity Severity in Preterm Infants via Measurement of Temporal Vessel Width and Angle. Front. Pediatr. 10:792724. doi: 10.3389/fped.2022.792724
0.2 摘要
视网膜病变(ROP)是一种发生在低出生体重早产儿中的视网膜疾病,是儿童可预防失明的主要原因。早期识别高危患者并及时诊断和治疗ROP可以显著改善患者的视觉预后。然而,手工筛查既耗费时间又耗费资源。使用眼底图像进行远程筛查有可能减轻现场筛查带来的负担。近年来,在使用眼底图像进行计算机辅助诊断方面取得了显著进展,这种方法引起了对眼科疾病诊断的广泛关注。
视网膜血管异常和变化可能与ROP的发生和发展有关。在这项研究中,我们检验了ROP严重程度可能与动脉和静脉的角度和宽度相关的假设。我们在正常条件下和不同ROP阶段计算了颞侧区域的动脉-动脉和静脉-静脉角度——颞侧动脉角度(TAA)和颞侧静脉角度(TVA)。我们还通过应用Radon变换方法估计了眼底图像中的血管宽度——颞侧动脉宽度(TAW)和颞侧静脉宽度(TVW)。
结果显示,随着ROP严重程度的增加,TAA和TVA显著下降,TAW和TVW显著增加(所有P < 0.0001)。此外,我们观察到TAA与TVA和TAW与TVW之间存在正相关关系(两者P < 0.0001)。TAA与TAW之间存在负相关关系(r = −0.162,P = 0.0314)。这些视网膜血管特征可能有助于眼科医生在早期检测ROP及其进展中发挥作用。
1. 引言
视网膜病变(ROP)是一种发生在早产儿中的血管性疾病,尤其是低出生体重(<1,500 g)和妊娠期年龄较小(<32周)的婴儿。早期检测该疾病并进行定期随访对于预防失明至关重要。在国际视网膜病变分类 [1,2] 中,根据疾病的严重程度,ROP被分为五个阶段(1-5期):第一阶段涉及血管与非血管周边视网膜的分界线;第二阶段涉及嵴;第三阶段涉及新生血管化;第四阶段涉及部分视网膜脱离;第五阶段涉及完全视网膜脱离 [2]。
为了检测需要治疗的病例,对ROP进行筛查至关重要,以便患者能够获得良好的预后。传统上,ROP筛查通过间接眼底镜检查在床旁进行[3]。由于现场筛查人员有限,使用远程筛查技术,即使用广角眼底相机捕捉眼底图像,已成为一种增加的方[4]。一项研究中,眼底图像上的ROP特征可以以高精度被识别[4]。
由于最近人工智能的发展,已经使用深度学习技术实现了通过识别“+”病变进行自动ROP诊断[5–9]。关于视网膜血管角度及其与ROP 关系的报告较少,特别是在ROP逐渐恶化的情况下 [10,11]。此外,一些研究已经确定了视网膜血管的宽度。例如,一项研究通过提取分割血管后的中心线并使用像素边缘来确定血管的宽度 [12] 。在另一项研究中,已经采用了基于高斯模型的方法来检测基于中心线血管强度的血管宽度,并使用Gabor滤波器通过眼底图像处理技术来确定基于眼底图像的血管宽度 [13] 。然而,这些研究使用了诸如二值化和骨架化等图像处理方法,并为每张图像设置了手动阈值。在自动图像处理技术中,精确确定血管中心线对于宽度测量的准确性至关重要,这在实践中难以实现。上述方法仅适用于高质量的视网膜图像,其中血管对比度和血管完全发育。然而,在早产儿的眼底图像中,血管可能尚未完全发育,图像质量可能较低,这可能导致血管宽度估计不准确。最后,血管角度和不同疾病严重程度阶段的宽度之间的关系尚未被研究。
为了解决这些局限性,本研究使用Radon变换(RT)算法自动从未患ROP和患ROP第一至第三阶段的婴儿的眼底图像中确定血管宽度。基于RT的算法具有鲁棒性,即使在存在噪声的情况下也能可靠地检测线性特征 [14,15]。此外,该算法可以跟踪信号质量较低的细血管结构。RT计算通过局部强度的积分执行;因此,基于空间相关性的高斯平滑实现了中心线平滑。据我们文献综述,血管角度与宽度之间的关联尚未报告。在本研究中,我们量化了颞侧动脉和颞侧静脉的角度,并确定了它们与血管宽度的关系以及这些关系在早产儿中的变化程度。我们发现了血管角度和宽度与 ROP 严重程度增加之间的关系。我们的研究结果可能为客观判断ROP严重程度提供信息,并可能补充和改进 ROP 筛查策略,以及辅助其诊断和管理。
2. 材料与方法
2.1 数据集详情
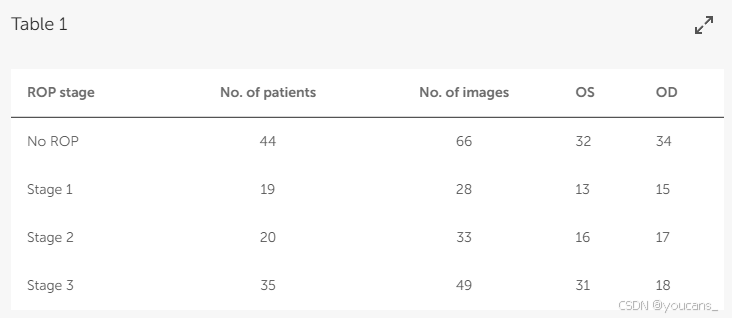
在本研究中,我们使用了一个包含在台湾林口长庚纪念医院进行ROP眼底筛查的早产儿眼底图像的数据集。所有图像均由眼科技术人员使用RetCam成像系统(RetCam III,Natus,Pleasanton,CA,USA)拍摄。对于体重≤1,500 g或妊娠年龄≤32周的婴儿,以及体重1,500–2,000 g或妊娠年龄32周且有任何不稳定临床状况的选定婴儿,进行了眼底检查;ROP筛查在出生后第四周进行([16]–[18])。本研究共使用了118名患者的资料。简而言之,数据包括44名未患ROP的婴儿的66张眼底图像,19名患ROP第一阶段的婴儿的28张眼底图像,20名患ROP第二阶段的婴儿的33张眼底图像,以及35名患ROP第三阶段的婴儿的49张眼底图像。所有数据均在2013年5月至2019年6月期间拍摄。在此,“无ROP”是指没有ROP的眼部健康状态。
数据详情见表1。
2.2 图像标注
所有眼底图像均由两位资深眼科专家(EYK和WCW)根据国际视网膜病变分类指南 [1,2] 进行标注。此外,图像中的血管在主要的上颞侧和下颞侧分支处被标注为动脉或静脉。
2.3 图像分析
所有眼底图像的分辨率为1,600 × 1,200。使用MATLAB软件测量了上颞侧和下颞侧动脉之间的角度以及上颞侧和下颞侧静脉之间的角度。颞侧动脉角度(TAA)通过沿上颞侧和下颞侧动脉绘制一条线来确定。算法在两条直线的交点处自动计算角度,使用反余弦函数。类似的方法用于测量每张图像中的颞侧静脉角度(TVA)。我们计算了数据集中所有图像中的TAA和TVA。
2.4 血管宽度估计
我们使用基于Radon变换(RT)的算法估计所有眼底图像中血管的宽度 [15]。基于RT的算法具有鲁棒性,即使在存在噪声的情况下也能很好地检测线性特征。图像的强度通常由于噪声的存在而波动;然而,当使用基于RT的算法时,这些波动通过积分过程消除。我们使用基于RT的线性特征检测算法提取血管的中心线。二维欧几里得空间上的RT可以如下推导得出:
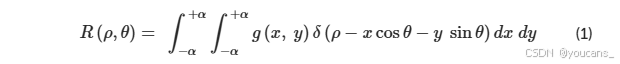
其中 g ( x , y ) g(x,y) g(x,y) 是位置 (x,y) 处的图像强度, δ \delta δ 是狄拉克δ函数, ρ \rho ρ 是从垂直于直线并通过原点的直线上原点的距离, θ \theta θ 是法线与x轴之间的角度。
RT算法强调图像中的线性特征,因为图像中的强度是在所有可能的直线上进行积分的。狄拉克δ函数的存在迫使 g ( x , y ) g(x,y) g(x,y) 在具有法线表示 ρ = x cos θ + y sin θ \rho = x\cos\theta + y\sin\theta ρ=xcosθ+ysinθ 的直线上进行积分([19])。眼底图像中显示血管的部分可能比背景部分具有更多的强度变化,并且可能包含血管曲率区域。通过RT算法,可以从先前值估计血管曲率和直径。使用高斯过程并通过对正负值使用零的均值来区分,可以识别曲率区域。首先,手动选择血管上的一个中心点并将其定义为中心线(Cn);随后指定目标方向点以预测Cn的方向。RT算法根据每个像素与选定Cn的距离为其分配权重(范围在0到1之间)。距离选定Cn更近的像素被分配更高的权重。通过三次插值计算线积分,在选定Cn附近形成了179个向量(图1A)。基于目标方向和中心像素与血管边缘像素强度相似性,从初始中心点计算对应的Cn并向前移动一步。这一过程将持续进行,直到到达目标点。
为了确定血管宽度,我们在血管方向上计算了另一个具有平行线积分的RT(图1B)。由于血管边界通常比血管背景更暗,因此可以确定血管边缘。通过计算顶边缘像素与相应底边缘像素之间的欧几里得距离来计算直径。这些值的平均值被视为血管宽度。
在确定血管宽度时,我们考虑了最多100个像素的长度,因为TAA和TVA测量是在视盘附近进行的。我们使用RT算法量化视网膜颞侧的上颞侧和下颞侧动脉及静脉宽度。我们通过平均上颞侧和下颞侧动脉宽度以及静脉宽度分别获得了颞侧动脉宽度(TAW)和颞侧静脉宽度(TVW)。我们从所有图像中获得了TAW和TVW值,除了来自2期ROP患者的3张图像,我们无法从中推导出TAW值。具体来说,在这3张图像中,我们只能准确确定下颞侧动脉宽度,因为在图像中相邻的静脉重叠了动脉。
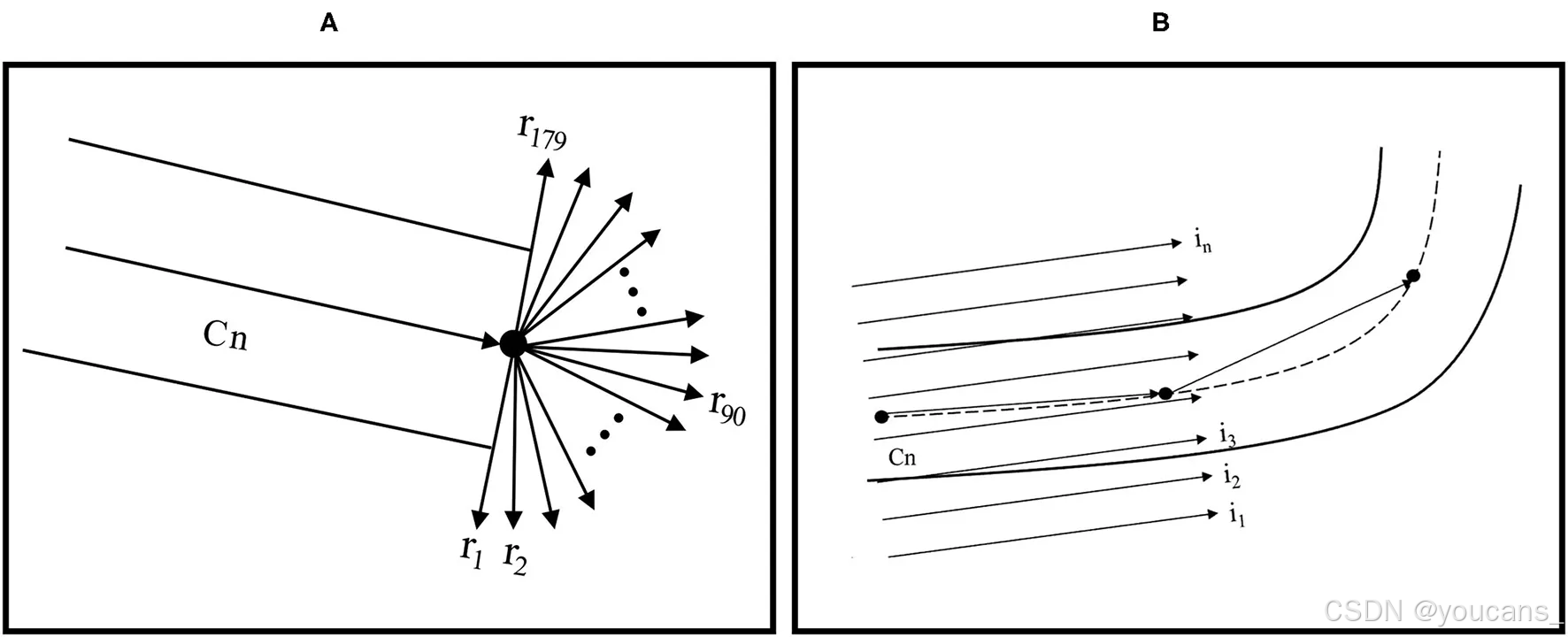
图1:(A) RT特征提取和中心线跟踪 (B) 使用线性积分计算血管边缘特征
2.5 统计分析
在分析数据之前,我们确认数据集中的数据是正态分布的。我们使用单因素方差分析(ANOVA)来识别无ROP、1期、2期和3期组之间的显著差异。随后,我们进行了Tukey多重比较检验以比较子组。为了确定TAA-TVA和TAW-TVW的相关性,我们使用皮尔逊相关系数r进行皮尔逊相关分析。统计分析使用GraphPad Prism软件9.0(GraphPad Software, San Diego, CA, USA)进行。P < 0.05被视为统计学显著。
3. 结果
本研究分析了118名早产儿的176张眼底图像。所有图像来自不同的眼睛;此外,60名患者双眼的图像也包含在内。
3.1 血管角度的确定
血管角度通过血管追踪确定。无ROP、1期ROP和2期ROP组的平均TAA值分别为122.42°±10.02°、114.23°±14.95°和111.87°±10.52°。3期ROP组的平均TAA值为92.72°±13.93°。因此,血管角度在不同程度的严重性上较小(无ROP vs. 3期ROP,P < 0.0001;表2)。类似的现象也出现在TVA上。无ROP、1期ROP、2期ROP和3期ROP组的平均TVA值分别为123.96°±16.55°、120.79°±18.65°、115.26°±14.83°和102.86°±21.91°(P < 0.0001)。不同ROP阶段的代表性TAA和TVA分别如图2和图3所示。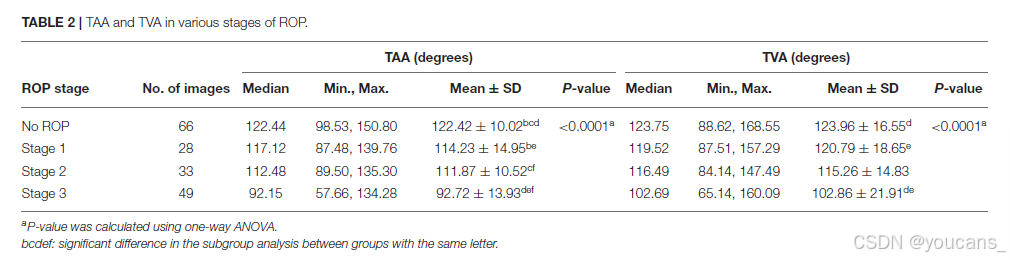
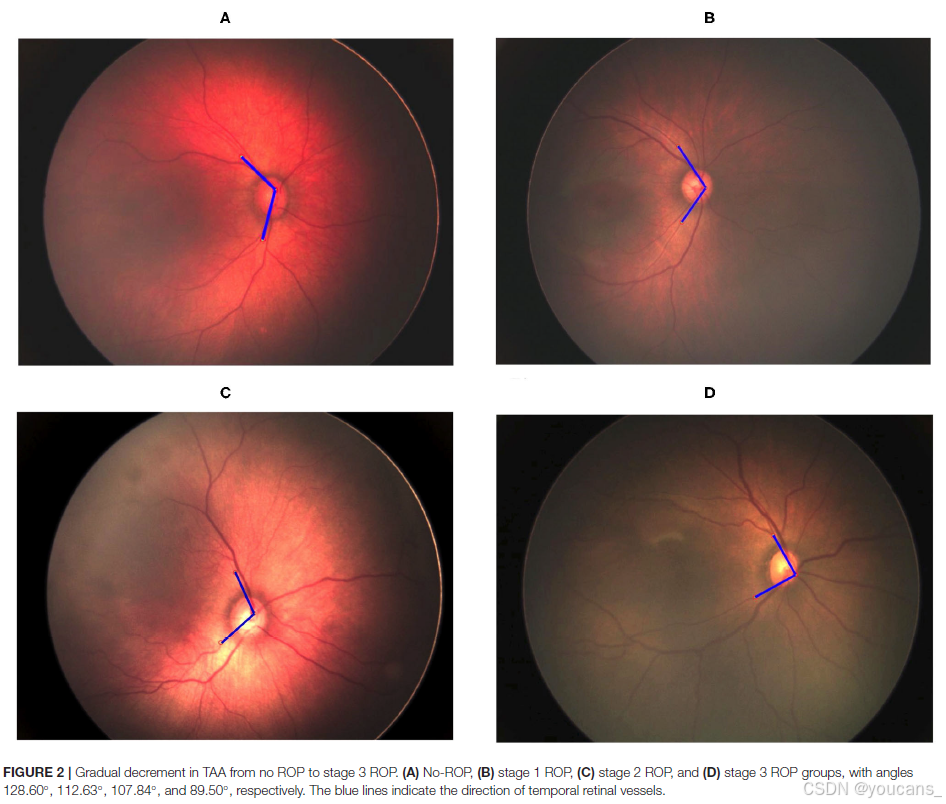
图2 | 从无ROP到3期ROP的TAA逐渐减小。
各组角度分别为(A)无ROP(128.60°),(B)1期ROP(112.63°),(C)2期ROP(107.84°),(D)3期ROP(89.50°)。蓝色线条指示颞侧视网膜血管的方向。
图3 | 从无ROP到3期ROP的TVA逐渐减小。
各组角度分别为(A)无ROP(131.50°),(B)1期ROP(127.12°),(C)2期ROP(114.4°),(D)3期ROP(95.18°)。蓝色线条指示颞侧视网膜血管的方向。
3.2 血管宽度的确定
TAW通过所有图像中上颞侧和下颞侧动脉宽度的平均值获得,除了来自2期ROP患者的3张图像。对于这3张图像,我们只能确定下颞侧动脉宽度,因为上颞侧动脉被相邻的静脉重叠,使得准确确定宽度变得困难。在这种情况下,我们在分析中仅使用下颞侧血管宽度作为TAW。
我们在ROP严重程度组中观察到TAW和TVW之间存在显著差异(P < 0.0001和P = 0.0044;表3)。在子组分析中,3期ROP组的TAW和TVW显著大于无ROP组(两者P < 0.05)。代表性TAW和TVW的图分别如图4和图5所示。

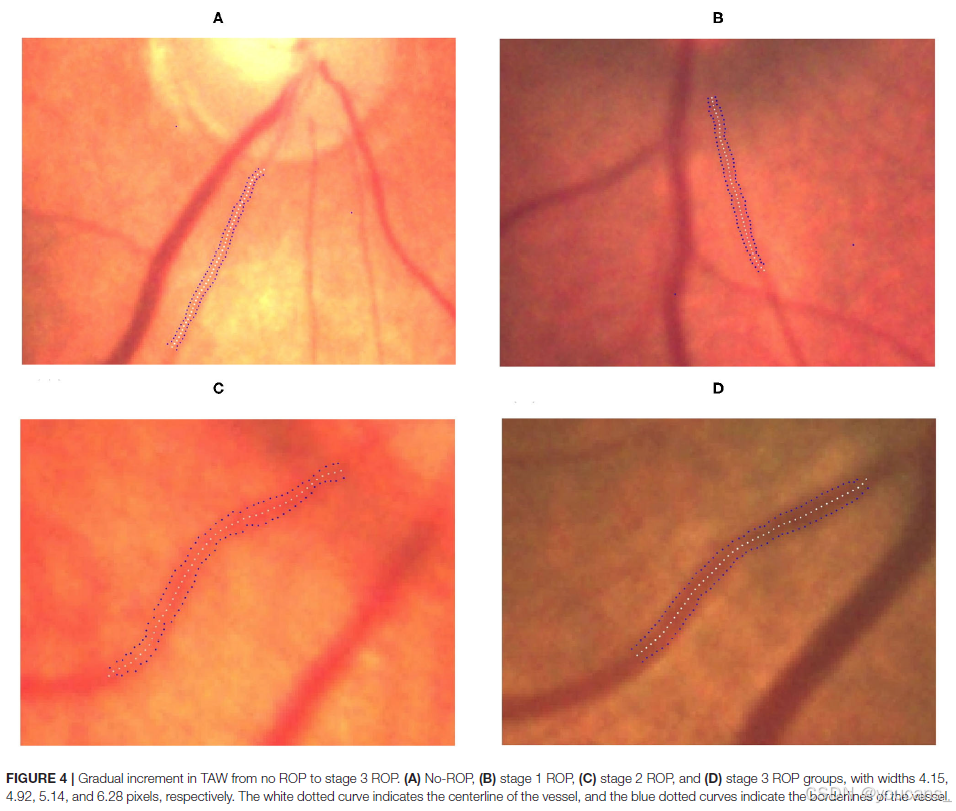
图4 | 从无ROP到3期ROP的TAW逐渐增加。
各组宽度分别为(A)无ROP(4.15像素),(B)1期ROP(4.92像素),(C)2期ROP(5.14像素),(D)3期ROP(6.28像素)。白色虚线曲线表示血管的中心线,蓝色虚线曲线表示血管的边界线。
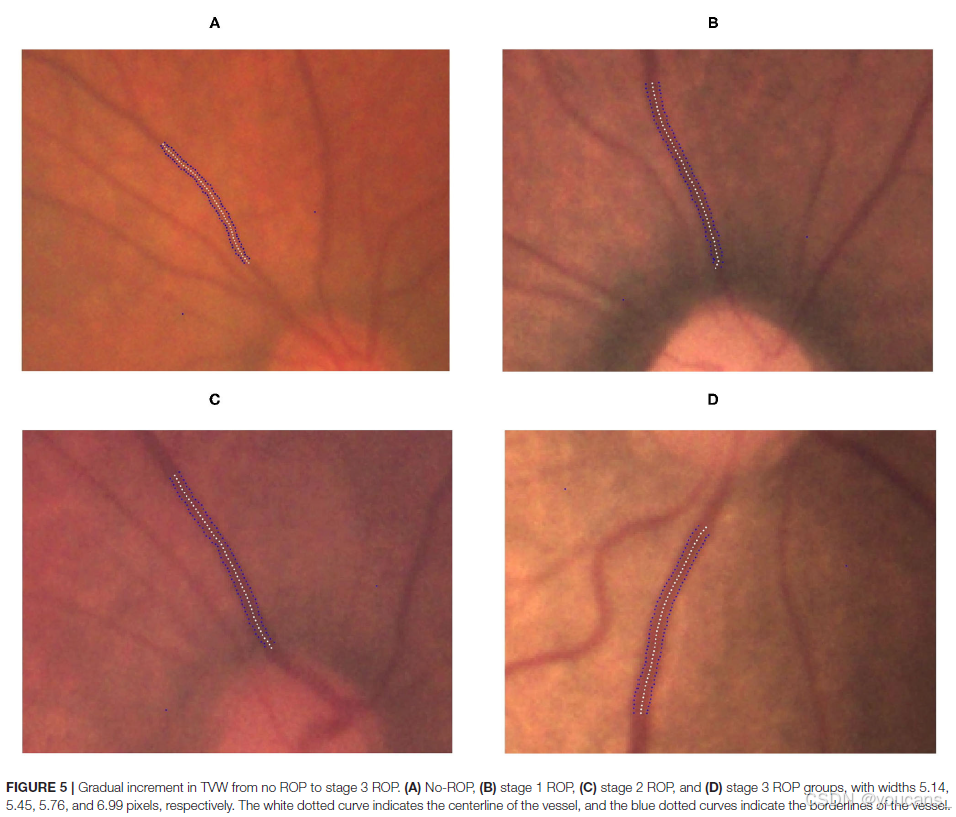
图5 | 从无ROP到3期ROP的TVW逐渐增加。各组宽度分别为(A)无ROP(5.14像素),(B)1期ROP(5.45像素),(C)2期ROP(5.76像素),(D)3期ROP(6.99像素)。白色虚线曲线表示血管的中心线,蓝色虚线曲线表
3.3 血管角度与血管宽度的相关性
绘制了所有ROP阶段的血管角度与血管宽度之间的相关性图。对每种相关性进行了线性回归分析,以确定TAA-TVA、TAW-TVW、TAA-TAW、TVA-TVW、TAA-TVW和TVA-TAW的相关系数(图6、图7)。

图6:绘制了(A)TAA与TVA之间的相关性图和(B)TAW与TVW之间的相关性图。
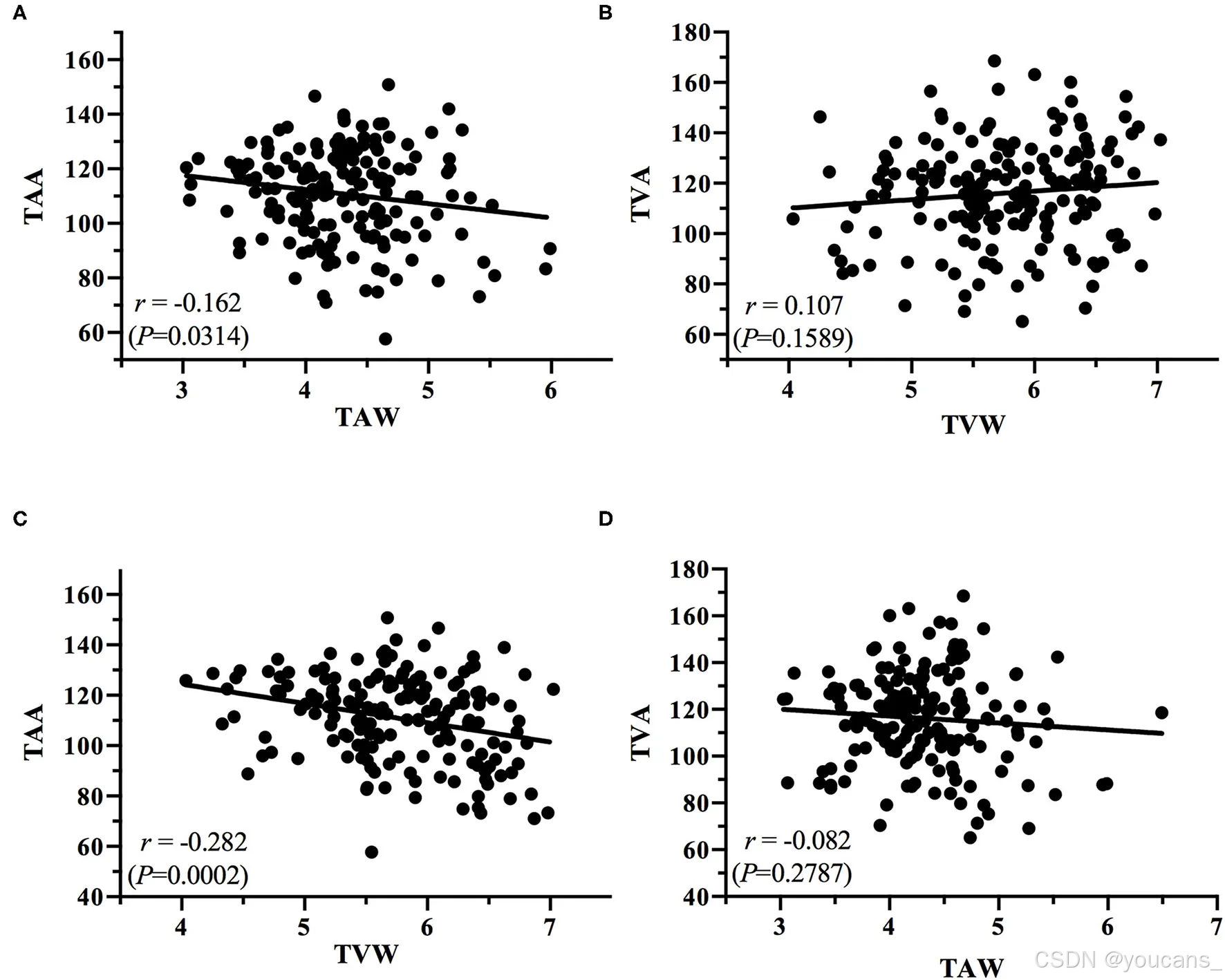
图7:绘制了(A)TAA与TAW之间的相关性图,(B)TVA与TVW之间的相关性图,(C)TAA与TVW之间的相关性图,以及(D)TVA与TAW之间的相关性图。
4. 讨论
本研究取得了一些显著发现。我们发现随着ROP严重程度的增加,TAA和TVA显著下降,TAW和TVW显著增加(所有P<0.0001)。此外,我们观察到TAA与TVA和TAW与TVW之间存在正相关关系(r=0.411,P<0.0001;r=0.362,P<0.0001),同时TAA与TAW、TAA与TVW、TVA与TAW之间存在负相关关系(r=−0.162,P=0.0314;r=−0.282,P=0.0002;r=−0.082,P=0.2787)。据我们所知,这是首次研究不同ROP阶段的时相血管角度和宽度之间的关系的研究。细微的视网膜血管变化至关重要,因为它们可以帮助临床医生早期检测ROP及其进展。血管角度和宽度的连续信息可以表明ROP是否在进展或退化。在ROP进展到较高阶段时识别出的眼部ROP进展,为外科医生提供了时间,以便在需要治疗ROP的阶段到达时能够及时进行治疗而不会延误。未来,这些特征可以被整合到一个用于远程医疗和人工智能时代自动ROP诊断的算法中。
先前的研究试图探讨无ROP和有ROP的早产儿的血管角度变化 [10, 11]。在其中一项研究中,通过在视网膜中心和视盘中心之间绘制垂直于视盘的轴线,手动测量了TVA,使用血管中垂直分隔视盘的点 [10]。该研究仅关注测量视网膜静脉角度。在另一项研究中,使用视盘中心半自动测量血管角度 [11];结果显示,无ROP组和轻度ROP(阶段1和2)组之间没有显著差异,但显示无ROP组和重度ROP(阶段3)组之间存在显著差异。在本研究中,我们最初使用视盘中心的方法来确定血管角度,但在我们的数据集中应用了这种方法。然而,我们观察到这种方法并不总是准确反映图像中的血管角度,因为并非所有血管交点都位于视神经中心。因此,在本研究中,我们修改了测量角度的方法。将上、下血管追踪回视盘,直到它们的交点。该交点的角度被视为血管角度。我们注意到,当前方法在准确确定血管角度方面更为可靠和精确。
本研究揭示了ROP阶段与时相血管角度之间存在负相关关系。从无ROP到阶段1、阶段2和阶段3 ROP,TAA和TVA的平均值逐渐下降。这些结果表明,随着ROP的进展,视网膜血管通过纤维血管增生而逐渐伸展。Wilson等人 [10] 报告,无ROP组与阶段3 ROP组右眼和左眼的TVA平均差异分别为6.1°和0.9°。Wong等人 [11] 指出,无ROP组与阶段3 ROP组的中位TAA和TVA差异分别为16°和13°。在本研究中,无ROP组与阶段3 ROP组的中位TAA和TVA差异分别为30.29°和21.06°(表2),明显大于先前报告的差异 [10, 11]。Wong等人 [11]假设,早产后,动脉角度比静脉角度受到的影响更大。在我们的研究中,视网膜动脉角度和视网膜静脉角度均显著受ROP疾病进展的影响,并且这些角度与血管宽度相关。
除了血管角度的下降,我们还观察到不同阶段ROP的血管宽度变化。视网膜血管扩张,这是加号疾病参数的一部分,可能与ROP眼中血管内皮生长因子水平的增加有关 [20, 21]。我们使用基于RT的算法精确检测线性特征,即使在噪声存在的情况下也能估计所有ROP阶段的血管宽度 [14, 15]。结果显示,阶段3 ROP组的TAW和TVW值显著大于无ROP组(表3)。然而,无ROP组与阶段1 ROP组和无ROP组与阶段2 ROP组之间的差异不显著。我们的结果表明,在ROP早期阶段(阶段1和2),血管宽度可能不会受到血管角度变化的显著影响,但当疾病进展到阶段3时,血管宽度会发生显著变化。
动脉和静脉的血管角度和宽度存在相关性。从无ROP阶段到阶段3 ROP,血管角度的下降(TAA与TAW;TVA与TVW)与血管宽度的增加相关。我们发现了TAA与TVA和TAW与TVW之间的正相关关系(图6),而TAA与TAW(图7A)、TAA与TVW(图7C)和TVA与TAW(图7D)之间的负相关关系。这些数据显示,仅使用这些测量中的一个可以在未来的研究中获得有意义的结果。
本研究的主要发现如下。首先,我们证实了ROP严重程度与动脉和静脉的角度和宽度有关的假设。时相血管角度和宽度之间的关系是新的发现,据我们所知,先前的研究尚未报告。第二,其他研究测量了以视盘为中心的视网膜角度,这不准确,因为并非所有血管都交于视盘中心。我们测量了血管在离开视盘边缘时的角度,并将线延伸到交点;这种方法可以更好地反映血管的实际角度。第三,使用RT测量时相血管宽度是一种新的方法,提供了可靠的结果。随着ROP的进展发现的细微视网膜血管变化可以为临床医生提供客观反馈,帮助临床决策。
本研究有一些局限性。首先,用于本研究的数据集包含的阶段1和2 ROP患者图像数量较少,与无ROP和阶段3 ROP组相比,这可能导致无ROP、阶段1 ROP和阶段2 ROP组之间视网膜血管特征的差异不显著。其次,由于视网膜血管分支模式的巨大变化,动脉和静脉注释必须手动进行,这是一项耗时的过程。第三,由于在拍摄照片时没有对婴儿进行镇静,婴儿在拍摄过程中可能会移动,导致图像质量不总是高质量的,从而难以准确确定血管宽度。
总之,本研究证明了ROP的严重程度与视网膜血管角度和宽度有关。我们发现ROP严重程度与视网膜血管角度之间存在负相关关系,但发现ROP严重程度与视网膜血管宽度之间存在正相关关系。这些数据是宝贵的,可以作为疾病进展或退化的指标。该领域需要进一步的研究。随着人工智能技术的进一步发展,本研究中发现的细微变化可以与科学的计算机辅助方法相结合,为临床医生提供关于ROP进展或退化的客观判断
5. 参考文献
1. International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited. Arch Ophthalmol. (2005) 123:991–9. doi: 10.1001/archopht.123.7.991
2. Chiang MF, Quinn GE, Fielder AR, Ostmo SR, Paul Chan RV, Berrocal A, et al. International classification of retinopathy of prematurity, third edition. Ophthalmology. (2021) 128:e51–68. doi: 10.1016/j.ophtha.2021.05.031
3. Thanos A, Yonekawa Y, Todorich B, Moshfeghi DM, Trese MT. Screening and treatments using telemedicine in retinopathy of prematurity. Eye Brain. (2016) 8:147–51. doi: 10.2147/EB.S94440
4. Brady CJ, D’Amico S, Campbell JP. Telemedicine for retinopathy of prematurity. Telemed J E Health. (2020) 26:556–64. doi: 10.1089/tmj.2020.0010
5. Tan Z, Simkin S, Lai C, Dai S. Deep learning algorithm for automated diagnosis of retinopathy of prematurity plus disease. Transl Vis Sci Technol. (2019) 8:23. doi: 10.1167/tvst.8.6.23
6. TingDSW, Pasquale LR, Peng L, Campbell JP, Lee AY, Raman R, et al. Artificial intelligence and deep learning in ophthalmology. Br J Ophthalmol. (2019)103:167–75. doi: 10.1136/bjophthalmol-2018-313173
7. Gensure RH, Chiang MF, Campbell JP. Artificial intelligence for retinopathy of prematurity. Curr Opin Ophthalmol. (2020) 31:312–7. doi: 10.1097/ICU.0000000000000680
8. Huang Y-P, Vadloori S, Chu H-C, Kang EY-C, Wu W-C, Kusaka S, et al. Deep learning models for automated diagnosis of retinopathy of prematurity in preterm infants. Electronics. (2020) 9:1–16. doi: 10.3390/electronics90
91444
9. Tong Y, Lu W, Deng QQ, Chen C, Shen Y. Automated identification of retinopathy of prematurity by image-based deep learning. Eye Vis (Lond). (2020) 7:40. doi: 10.1186/s40662-020-00206-2
10. Wilson C, Theodorou M, Cocker KD, Fielder AR. The temporal retinal vessel angle and infants born preterm. Br J Ophthalmol. (2006) 90:702–4. doi: 10.1136/bjo.2005.085019
11. Wong K, Ng J, Ells A, Fielder AR,Wilson CM. The temporal and nasal retinal arteriolar and venular angles in preterm infants. Br J Ophthalmol. (2011) 95:1723–7. doi: 10.1136/bjophthalmol-2011-300416
12. Lowell J, Hunter A, Steel D, Basu A, Ryder R, Kennedy RL. Measurement of retinal vessel widths from fundus images based on 2-D modeling. IEEE Trans Med Imaging. (2004) 23:1196–204. doi: 10.1109/TMI.2004.830524
13. Oloumi F, Rangayyan RM, Casti P, Ells AL. Computer-aided diagnosis of plus disease via measurement of vessel thickness in retinal fundus images of preterm infants. Comput Biol Med. (2015) 66:316–29. doi: 10.1016/j.compbiomed.2015.09.009
14. Zhang Q, Couloigner I. Accurate centerline detection and line width estimation of thick lines using the Radon transform. IEEE Trans Image Process. (2007) 16:310–6. doi: 10.1109/TIP.2006.887731
15. Asl ME, Koohbanani NA, Frangi AF, Gooya AM. Tracking and diameter estimation of retinal vessels using Gaussian process and Radon transform. J Med Imaging. (2017) 4:1–14. doi: 10.1117/1.JMI.4.3.034006
16. Chiang MC, Tang JR, Yau KI, Yang CM. A proposal of screening guideline for retinopathy of prematurity in Taiwan. Acta Paediatr Taiwan. (2002) 43:204–7. doi: 10.7097/APT.200208.0204
17. Li ML, Hsu SM, Chang YS, Shih MH, Lin YC, Lin CH, et al. Retinopathy of prematurity in southern Taiwan: a 10-year tertiary medical center study. J Formos Med Assoc. (2013) 112:445–53. doi: 10.1016/j.jfma.2012.03.002
18. Chen YH, Lien RI, Tsai S, Chang CJ, Lai CC, Chao AN, et al. Natural history of retinopathy of prematurity: two-year outcomes of a prospective study. Retina. (2015) 35:141–8. doi: 10.1097/IAE.0000000000000270
19. Copeland AC, Ravichandran G, Trivedi, MM. Localized radon transformbased detection of ship wakes in SAR images. IEEE Trans Geosci Remote Sens. (1995) 33:35–45. doi: 10.1109/36.368224
20. Goldberg MA, Schneider TJ. Similarities between the oxygensensing mechanisms regulating the expression of vascular endothelial growth factor and erythropoietin. J Biol Chem. (1994) 269:4355–9. doi: 10.1016/S0021-9258(17)41787-X
21. Madan A, Penn JS. Animal models of oxygen-induced retinopathy. Front Biosci. (2003) 8:d1030–1043. doi: 10.2741/1056
版权说明:
本文由 youcans@qq.com 对论文【Computer-Aided Detection of Retinopathy of Prematurity Severity in Preterm Infants via Measurement of Temporal Vessel Width and Angle】进行摘编和翻译。该论文版权属于原文期刊和作者,本译文只供研究学习使用。
youcans@qq.com 作品,转载必须标注原文链接:
【医学影像 AI】基于Radon变换检测血管宽度和角度诊断 ROP 病变(https://youcans.blog.csdn.net/article/details/151370742)
更多内容请关注【医学影像 AI by youcans@Xidian 专栏】
Crated:2025-09
更多推荐
 已为社区贡献197条内容
已为社区贡献197条内容






所有评论(0)