Brain Imaging Behav:失眠与广泛性焦虑障碍静息态脑活动的比较:一项基于坐标的元分析
本研究采用ALE元分析方法,比较了失眠障碍(ID)与广泛性焦虑障碍(GAD)患者的静息态脑功能活动特征。通过分析21项ID研究和16项GAD研究的ALFF/fALFF/ReHo数据,发现两种障碍在左侧后扣带回和楔前叶均表现出活动增强,在左侧内侧前额叶皮层均表现为活动降低,提示这些DMN相关脑区的异常可能是共病的基础神经机制。此外,GAD患者在左侧额上回表现出比ID更显著的脑活动增强,这可能是两种障
简要总结
本研究采用基于坐标的激活似然性评估(ALE)元分析方法,系统比较了失眠障碍(ID)与广泛性焦虑障碍(GAD)在静息态脑功能活动上的共性与差异性。研究纳入分析指标为 ALFF、fALFF 与 ReHo的静息态功能磁共振成像文献,共包括21项ID与健康对照研究和16项GAD与健康对照研究。结果显示,ID 与GAD 在默认模式网络相关脑区表现出一致的异常模式,即左侧后扣带回和左侧楔前叶活动增强,而左侧内侧前额叶皮层活动降低。此外,与ID相比,GAD患者在左侧额上回表现出更显著的脑活动增强,提示两者在执行控制与情绪调节机制上存在差异。该研究为理解ID与GAD的共同神经基础及特异性机制提供了可靠的神经影像学证据,并对精准干预具有潜在启示意义。
摘要
失眠障碍(insomnia disorder,ID)患者通常承受更为沉重的焦虑共病负担。然而,ID与焦虑之间相互关系的神经机制仍然尚不明确。研究旨在采用基于坐标的激活似然性评估(activation likelihood estimation,ALE)方法,探讨ID患者与广泛性焦虑障碍(generalized anxiety disorder,GAD)患者在脑区功能活动上的一致性与差异性。本研究通过检索截至2024年5月24日的多个数据库,纳入了使用静息态功能磁共振成像(rs-fMRI)指标的研究,指标包括局部一致性(regional homogeneity,ReHo)、低频振幅(amplitude of low-frequency fluctuations,ALFF)及分数低频振幅(fractional ALFF,fALFF),研究对象为ID或GAD患者。采用元分析方法,最终纳入了21项ID与健康对照(healthy controls,HC)比较的研究以及 16项GAD与HC比较的研究,以揭示两种障碍之间的共同与特异性脑功能模式。结果显示,ID与GAD患者在左侧后扣带回(posterior cingulate cortex)和左侧楔前叶(precuneus)表现出一致的脑活动增强,同时在左侧内侧前额叶皮层(medial prefrontal cortex,mPFC)表现出一致的脑活动降低。此外,与ID相比,GAD患者在左侧额上回(superior frontal gyrus)表现出更显著的脑活动增强。本研究揭示了ID与GAD患者在脑功能活动上的共性与差异性激活模式,为理解这两种障碍的神经生物学基础提供了新的见解,并为未来开发更具针对性的治疗策略提供了潜在依据。
关键词:失眠障碍、广泛性焦虑障碍、静息态功能磁共振成像、神经影像、ALE元分析
1 引言
失眠障碍是一种最为常见的睡眠障碍,主要表现为入睡困难、维持睡眠困难或睡眠缺乏恢复感,并常伴随情绪障碍以及注意力和记忆功能受损。ID在全球人群中的患病率约为4%–22%。越来越多的证据表明,ID与焦虑障碍之间存在着密切关联。研究显示,约33.1%的ID患者同时患有焦虑障碍,其中约一半为广泛性焦虑障碍(generalized anxiety disorder,GAD)。除睡眠质量下降外,患GAD共病的ID患者常表现出广泛性的焦虑、不合理的担忧、不安、肌肉紧张以及自主神经系统亢进等症状。失眠在GAD患者中同样是一种普遍存在的问题,并且会进一步加重焦虑症状。此外,长期失眠被认为是增加GAD发病风险的潜在危险因素。多导睡眠监测研究发现,GAD患者表现出总睡眠时间显著减少以及入睡潜伏期延长。此外,研究还发现,失眠可导致睡眠觉醒周期失调、持续性注意功能受损、冲动性增加、焦虑水平升高以及记忆功能受损,而这些均是GAD的常见临床症状。进一步的研究强调,神经递质和激素分泌异常参与了ID与GAD共同的病理过程。近期一项综述指出,遗传因素与失眠、焦虑等精神障碍之间存在密切关联。因此,深入探讨这两种障碍在发病机制中的共同与特异性神经生物学基础具有重要意义。
静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)技术为探测内在神经生物学变化提供了一种无创且可视化的手段,并已被广泛应用于ID和GAD的研究中。低频振幅(amplitude of low-frequency fluctuation,ALFF)、分数低频振幅(fractional ALFF,fALFF)以及局部一致性(regional homogeneity,ReHo)是目前用于检测ID与GAD患者脑区局部功能活动的可靠且常用指标。ALFF和fALFF用于测量特定频段(如0.01–0.08 Hz)内某一时间序列的总信号强度,被认为是反映脑区血氧水平依赖(BOLD)信号自发波动强度的有效方法。ReHo则反映某一体素与其周围体素之间在时间序列上的一致性。针对ID患者的研究发现,与警觉性、情绪和认知功能相关的多个脑区存在ALFF和ReHo的异常改变,包括额叶、楔前叶、扣带回皮层、海马以及边缘系统。此外,针对GAD患者的rs-fMRI研究表明,其脑区功能异常主要涉及奖赏系统、情绪系统、认知系统、内感受系统以及躯体症状相关系统,具体包括前额叶、扣带回、楔前叶以及颞叶和顶叶。一项比较ID与GAD的研究发现,与ID患者相比,GAD 患者的杏仁核与前扣带皮层之间的功能连接增强。然而,Li 等指出,与失眠障碍共病的GAD 患者在后扣带回皮层(posterior cingulate cortex,PCC)表现出更高的功能活动,相比未患失眠障碍的GAD患者更为显著。由于现有研究普遍存在样本量较小、临床异质性较高以及测量指标单一等问题,基于单项独立研究难以得出一致结论。因此,有必要通过元分析的方法,更为可靠地揭示ID与GAD之间脑功能活动的共性与差异性改变。
元分析是一种能够以综合方式整合不同研究中神经影像学发现的有力工具。基于坐标的激活似然性评估能够高效整合各研究报告的坐标信息,用以确定特定脑区发生激活或去激活的统计概率。与其他基于坐标的方法相比,ALE能够对不同标准空间中的坐标进行转换,并实现跨标准空间的比较,同时具有较高的敏感性和准确性。迄今为止,ALE元分析已被广泛应用于处理静息态功能磁共振成像研究中的异质性问题,以及探索两种疾病之间共同或不同的神经影像学机制。例如,Duan 等采用基于坐标的rs-fMRI元分析方法,探讨了失眠与阻塞性睡眠呼吸暂停之间潜在的神经影像学差异。
在临床层面,失眠与焦虑被认为存在密切联系。例如,认知行为疗法(cognitive behavioral therapy,CBT)不仅可在ID患者中产生轻至中度的焦虑症状改善效果,同时也能够改善GAD患者的睡眠质量。然而,目前针对ID与焦虑障碍之间神经影像差异与共性的基于坐标的元分析研究仍然较少。因此,本研究采用ALE方法,探讨ID与GAD相互关系背后的神经机制。
本研究旨在探索ID与GAD神经机制上的一致性与差异性。鉴于直接比较ID与GAD的研究文献数量有限,研究纳入了分别将ID或GAD患者与健康对照人群进行比较的研究,并整合单一患者组的脑激活结果,以探讨两种疾病之间的重叠区域与差异区域。本研究仅纳入了采用全脑分析方法(ALFF、fALFF 和 ReHo)来探讨ID与GAD关系的原始研究。然而,由于不同研究中研究者选取的种子点或感兴趣区域(ROIs)并不一致,使得在元分析后对功能连接结果的可解释性较差,因此本研究未纳入采用FC分析的研究。本研究有助于加深对ID与GAD病理机制的理解,并为未来开发更具针对性的治疗策略提供潜在启示。
2 方法
2.1 搜索策略
本研究严格按照系统评价和meta分析的优先报告条目(Preferred Reporting Items for Systematic Reviews and Meta-Analyses,PRISMA)指南开展,并已在PROSPERO数据库注册(注册号:CRD42023469989)。
通过系统且全面的检索策略,从 PubMed、Embase、Web of Science、Cochrane Library、SinoMed、中国知网(CNKI)、万方数据库以及中国科技期刊数据库(VIP)中检索截至2024年5月24日已发表或“在线优先发表”的相关文献。
针对ID研究,检索关键词包括:
(“fMRI”或“functional MRI”或“functional magnetic resonance imaging”或“ALFF”或“fALFF”或 “fractional amplitude of low frequency fluctuations”或“amplitude of low frequency fluctuations”或“ReHo”或“regional homogeneity”)与(“insomnia disorder”或“insomnia disorders”或“insomnia”或“primary insomnia”或“chronic insomnia”)的组合。
针对广泛性焦虑障碍(GAD)研究,检索关键词包括:
(“fMRI”或“functional MRI”或“functional magnetic resonance imaging”或“ALFF”或“fALFF”或“fractional amplitude of low frequency fluctuations”或“amplitude of low frequency fluctuations” 或“ReHo”或“regional homogeneity”)与(“generalized anxiety disorder”或 “generalized anxiety disorders”或“GAD”)的组合。
中文检索词为上述英文检索词的对应翻译。根据不同数据库的特点,对检索式和筛选条件进行了相应的调整与优化。此外,还对已纳入研究及相关综述文章的参考文献列表进行了手工检索,以识别可能遗漏的研究。本项元分析已在 PROSPERO数据库注册(注册号:CRD42023469989)。
2.2 纳入与排除标准
纳入标准如下:
(1)研究对象为ID或GAD患者,其诊断依据符合《精神障碍诊断与统计手册》(Diagnostic and Statistical Manual of Mental Disorders,DSM)或《国际疾病分类》(International Statistical Classification of Diseases,ICD)的相关标准;
(2)研究采用全脑分析方法,比较ID或GAD患者与健康对照之间的局部一致性(ReHo)、低频振幅(ALFF)或分数低频振幅(fALFF)的差异;
(3)研究结果以Talairach坐标或蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)坐标形式报告;
(4)结果报告采用了多重比较校正后的显著性阈值,或采用未校正但设置了空间范围阈值的统计标准;
(5)研究以英文或中文撰写,并发表于同行评议期刊。
排除标准如下:
(1)个案报告、会议摘要、社论、评论性文章或不包含原始数据的综述研究;
(2)未进行患者组与健康对照组直接组间比较的研究;
(3)采用基于种子点分析(seed-based analysis)或仅报告感兴趣区(region of interest,ROI)结果的研究;
(4)每组被试人数少于 10人的研究(为提高结果的可靠性与稳定性予以排除);
(5)无法获取峰值坐标或参数图的研究。
2.3 质量评估与数据提取
由两名研究员(T. J 和X. Y)独立完成文献检索、研究筛选及数据提取工作,所有信息均进行了交叉核对。如出现分歧,则由第三名研究员(J. G)协调并作出最终裁决。同时,两名研究员还依据一份12项质量评估清单对纳入研究的质量进行独立评估,该清单已被广泛应用于神经影像学元分析研究中。
从每项纳入研究中提取了人口学与临床资料、影像学参数、统计学信息以及完整的立体定位峰值坐标。其中,以Talairach坐标报告的结果通过 Ginger ALE 软件中的icbm2tal转换方法统一转换至MNI空间。
2.4 ALE元分析
基于坐标的元分析采用修订版激活似然性评估(activation likelihood estimation,ALE)算法,并使用 GingerALE3.0.2软件包(http://www.brainmap.org/ale)完成。ALE元分析的具体流程已在既往文献中作了详细阐述,其基本步骤概述如下:ALE 方法首先计算神经影像研究中报告的激活坐标(foci)在空间上的统计聚合程度,并为每个坐标建立三维高斯概率分布以生成模型激活(modeled activation,MA)图;随后,通过对所有MA图进行联合,生成ALE图像;最后,通过检验实验之间空间关联为随机分布的零假设,验证激活坐标的空间聚合是否具有统计学意义。
从纳入研究中提取的所有坐标依据患者相对于健康对照(HC)的区域脑功能活动变化方向进行整合,并划分为四个对比组:ID > HC、ID < HC、GAD > HC 以及 GAD < HC。本研究采用两阶段分析策略。首先,分别针对上述四种对比进行一级ALE分析,统计阈值设定为体素水平未校正 p < 0.005,最小簇体积为 100 mm³。随后,将一级分析结果进一步纳入二级合并/对比分析(conjunction/subtraction analysis),以识别ID与GAD之间共同及特异的脑区激活模式。二级分析构建了两个模型:其一用于比较脑活动增强的区域(即 ID > HC 与 GAD > HC),其二用于比较脑活动降低的区域(即 ID < HC 与 GAD < HC)。二级分析采用定量联合分析方法,并通过5000次非参数置换检验进行统计推断,以评估ID与GAD之间的差异。为降低假阳性率,采用GingerALE中的伪发现率(false discovery rate,FDR)校正方法(pN选项),校正阈值设定为 q<0.05,同时设置最小簇体积为 20 mm³,并进行 5000 次置换。最终获得的ALE簇图叠加显示于 Colin 脑解剖模板(http://brainmap.org/ale/colin27_T1_seg_MNI.nii)上,该模板已通过 Multi-Image Analysis GUI(Mango)图像处理系统(http://ric.uthsca.edu/mango)标准化至 MNI 空间。
2.5 控制分析
为评估研究结果的稳健性并控制单个研究对整体结果的影响,本研究采用Jackknife(逐一剔除)分析方法进行控制分析。具体而言,依次剔除每一项纳入研究,并对剩余研究重新进行分析。若主要脑区簇在全部或绝大多数重复分析中仍保持统计学显著性,则可认为该脑区结果具有较高的可重复性和稳定性。
3 结果
3.1 Study selection and characteristics
图 1展示了ID与GAD研究的文献筛选流程及研究特征。最终,共纳入21项ID研究(其中 13 篇英文文献、8 篇中文文献)和16项GAD研究(其中11篇英文文献、5篇中文文献)。最终样本共包括690名ID患者、711 名GAD患者以及1384名健康对照,其中620名HC来自ID与HC的比较研究,764名HC来自GAD与HC的比较研究。在21项ID研究中,有14项报告了患者的焦虑水平,其中9项研究的ID患者同时患有轻度焦虑症状。然而,所有纳入的GAD研究均未报告GAD患者失眠严重程度,因此无法确定GAD患者是否同时患有失眠症状。在ID的元分析中,19个实验报告了ID > HC的脑区激活差异,共涉及63个激活峰值坐标;18个实验报告了ID < HC的脑区去激活差异,共涉及71个去激活峰值坐标。在GAD的元分析中,16个实验报告了GAD > HC的脑区激活差异,共涉及60个激活峰值坐标;11 个实验报告了GAD < HC的脑区去激活差异,共涉及39个去激活峰值坐标。各疾病样本的人口学特征、临床资料及神经影像学方法详见表 1 和表 2。
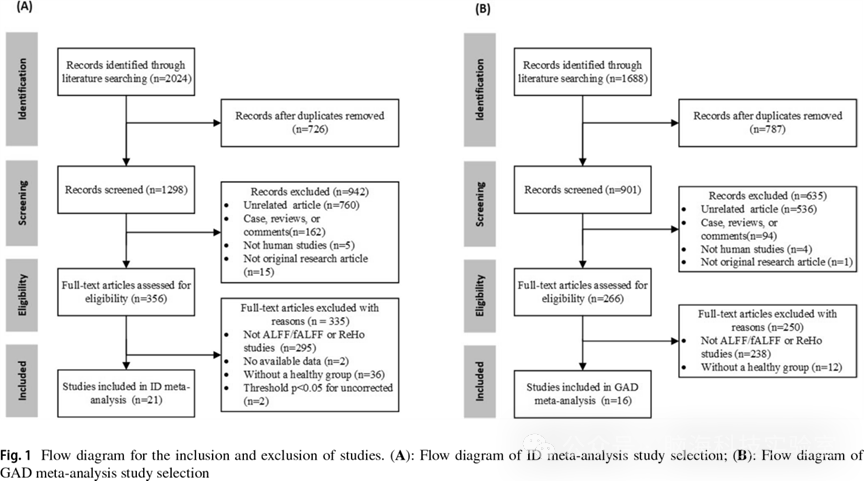
图1 ID与GAD研究的文献筛选流程及研究特征
表1 各疾病样本的人口学特征、临床资料


表2 各疾病样本的神经影像学方法

所有纳入研究的整体质量评价结果显示,研究质量总体一致且较高。ID与GAD 研究的平均质量评分分别为11.86 分(范围:11–12 分)和11.69 分(范围:10–12 分)。各研究的详细质量评分结果见附录表 4。
3.2 元分析主要结果
ID/GAD与健康对照的一级ALE元分析结果见附录表 5。对ID与GAD相关文献进行的联合分析与对比分析揭示了两种障碍在脑功能活动增强与降低方面的重叠脑区,以及脑功能激活的显著差异。二级分析结果如下所示。
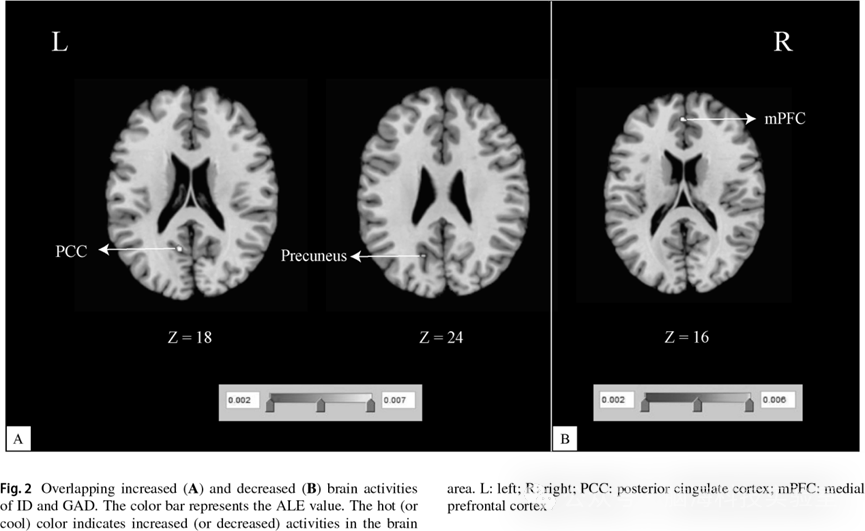
图2 二级分析结果;重叠的脑活动增强区域(图 2A);重叠的脑活动降低区域(图 2B)
ID > HC 与 GAD > HC 的联合分析结果显示,左侧后扣带回(posterior cingulate cortex,PCC)和左侧楔前叶(precuneus)为两种障碍中共同表现出脑活动增强的脑区(见表 3、图 2A)。ID < HC 与 GAD < HC 的联合分析结果表明,两种障碍中共同表现出脑活动降低的脑区位于左侧内侧前额叶皮层(medial prefrontal cortex,mPFC)(见表 3、图 2B)。
表3 展示ID和GAD之间重叠和不同的大脑激活区域的聚类

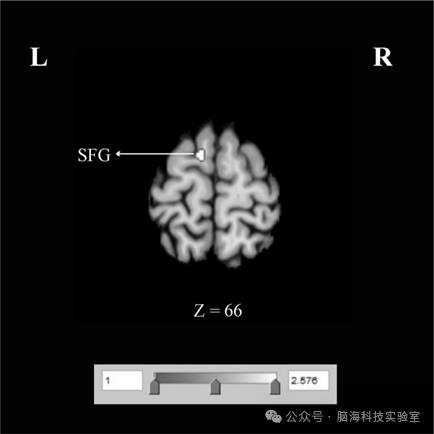
图3 显著差异的脑活动增强区域
在脑活动增强差异的对比分析中发现,与 ID 患者相比,GAD 患者在左侧额上回(superior frontal gyrus,SFG)表现出更显著的脑活动增强(见表 3、图 3)。
显著差异的脑活动降低区域
对比分析未发现 ID 与 GAD 之间存在显著差异的脑活动降低区域。
控制分析
对所有纳入的 ID 与 GAD 研究进行了Jackknife分析,具体结果见附录表 6。Jackknife分析结果显示,PCC、楔前叶、mPFC 与 SFG 的重复出现率分别达到36/37、37/37、35/37和34/37次分析,表明ALE元分析所识别的脑区具有较高的稳定性与可靠性。
4 讨论
在本研究中,采用基于坐标的激活似然性评估(ALE)元分析方法,探讨了ID与GAD之间脑功能活动的共性与差异性模式。综合元分析结果显示,ID与GAD在左侧后扣带回(posterior cingulate cortex,PCC)和左侧楔前叶(precuneus)表现出一致的脑活动增强,同时在左侧内侧前额叶皮层(medial prefrontal cortex,mPFC)表现出一致的脑活动降低。此外,与 ID 患者相比,GAD 患者在左侧额上回(superior frontal gyrus,SFG)表现出更显著的脑活动增强。进一步的 Jackknife分析表明,上述结果具有良好的稳定性与可重复性。本研究结果提示,ID与GAD均存在复杂的静息态脑功能异常,并为理解两种障碍在神经病理生理机制上的共性与特异性特征提供了更为可靠的神经影像学证据。
本研究的元分析结果显示,左侧后扣带回(posterior cingulate cortex,PCC)和左侧楔前叶(precuneus)存在一致性的脑活动增强模式。PCC是与自我相关加工、内感受以及情绪调节密切相关的关键脑区。既往研究表明,PCC 参与了ID的发病过程,且在ID患者的各个睡眠阶段中均表现出 PCC活动增强。此外,PCC在注意分配与信息理解中亦发挥重要作用。静息态下 PCC的过度激活提示情绪整合过程异常,可能导致ID与广泛性焦虑障碍患者出现难以控制的焦虑情绪。楔前叶不仅参与视觉加工,还与情境记忆及复杂认知功能密切相关。既往研究已报道ID患者楔前叶活动显著增强,同时该脑区的功能活动也被证实与焦虑情绪水平相关。因此,推测PCC与楔前叶的功能异常可能对ID与GAD患者的失眠与焦虑症状产生不利影响。
除上述过度激活脑区外,本研究还发现ID与GAD患者在左内侧前额叶皮层(medial prefrontal cortex,mPFC)存在一致性的脑活动降低。作为默认模式网络(default mode network,DMN)的关键节点,mPFC在信息接收、整合与传递过程中起着核心作用,并广泛参与情绪调控、决策、注意及警觉性维持。大量研究表明,mPFC参与REM睡眠的调节,且ID患者在该脑区表现出异常的功能活动。在GAD患者中,焦虑严重程度及内感受敏感性亦与mPFC的功能活动密切相关。本研究的元分析结果显示mPFC呈现去激活状态,可能反映了ID与GAD患者在内感受、信息加工及情绪表达方面的内在神经机制异常。总体而言,本研究发现ID与GAD患者的功能异常主要集中于默认模式网络相关脑区,提示DMN的异常活动可能是两种障碍共享的神经生物学基础,从而解释其在情绪调节、认知功能及记忆功能方面的受损表现。此外,控制分析结果显示主要发现具有良好的稳定性,进一步表明本项元分析结果具有较高的可靠性。
除功能活动的共性模式外,本研究还揭示了ID与GAD之间的功能活动差异。与ID患者相比,GAD患者在左侧额上回(superior frontal gyrus,SFG)表现出更显著的脑活动增强。大量fMRI研究表明,SFG是背外侧前额叶皮层(dorsolateral prefrontal cortex,DLPFC)的重要组成部分,而该脑区已被证实与焦虑和抑郁密切相关。SFG活动的增强可能导致GAD患者在执行功能、情绪调节及社会功能方面出现功能障碍。因此,本研究推测,左侧SFG在ID与GAD患者之间的功能差异,可能构成两种障碍临床表现不同的神经影像学基础。
值得注意的是,本研究结果具有一定的潜在临床应用价值。在临床实践中,认知行为疗法被认为是治疗ID与GAD的“黄金标准”心理干预方法。既往研究发现,CBT对ID的治疗机制可能与PCC与mPFC功能活动的调节有关;而多项研究也表明,CBT 可调节GAD患者在楔前叶、颞中回(middle temporal gyrus,MTG)以及mPFC中的异常脑活动。近年来,一些新的治疗技术(如针灸、经颅磁刺激及闭环刺激)已被证实对ID与GAD具有良好疗效,而fMRI研究显示,这些治疗方法可能通过调节默认模式网络的功能活动发挥作用。因此,ID与GAD之间既存在共性又存在差异的脑功能活动模式,可能为未来的干预靶点选择提供重要依据,并有助于推动精准化与个体化治疗策略的发展。
本项元分析仍存在若干需要说明的局限性。第一,鉴于直接比较ID与GAD的研究数量有限,本研究仅纳入了将ID或 GAD分别与健康对照进行比较的原始研究。未来研究可通过直接比较ID与GAD 患者来进一步验证本研究结果。第二,本研究不可避免地纳入了部分ID与GAD共病患者,这可能在一定程度上限制了结果的解释。后续研究可进一步直接聚焦于ID与GAD共病人群展开深入探讨。第三,除左侧额上回(SFG)外,本研究未发现ID与GAD在其他脑区存在显著的功能活动差异,这可能主要与现有研究数量有限有关。此外,反映ID与GAD差异的脑区可能对ALFF、fALFF和ReHo等区域自发活动指标的敏感性有限。未来研究可结合多种fMRI分析方法,如功能连接(functional connectivity)、体素镜像同伦连接(voxel-mirrored homotopic connectivity,VMHC)及弥散张量成像(diffusion tensor imaging,DTI),以更全面地探索两种障碍之间的异同。第四,ALE方法无法对统计异质性及发表偏倚进行评估。在既往基于ALE的元分析研究中,同样未报告异质性检验或发表偏倚结果。推测其原因可能包括:(1)ALE结果通常基于最大差异的坐标和 t 值,且这些差异可能分布于不同脑区,因而难以计算跨脑区的异质性;(2)多数研究未报告影像参数图的均值和标准差;(3)不同研究在MRI扫描设备、采集参数及分析方法上存在差异,且由于原始数据体量庞大,数据共享较少,从而增加了基于影像数据估计异质性的难度。第五,本研究未进一步分析神经影像学变化与临床症状之间的相关性。然而,在既往基于ALE的元分析研究中,同样较少开展元回归分析。第六,本研究采用了伪发现率(FDR)校正进行多重比较校正,该方法在空间相关性较强的结果中可能产生相对偏乐观的结论。未来在纳入更多原始研究后,可采用更为严格的校正方法(如cFWE 校正)对结果进行进一步验证。第七,在二级ALE分析中,本研究将最小簇体积设定为 20 mm³。既往研究尚无统一标准,常见的簇体积范围为20–150 mm³。结合本研究数据,选择 20 mm³ 作为最小簇体积,以在尽量保留激活脑区的同时降低假阳性风险。未来研究可进一步探索最优参数设定,以更准确地识别反映ID与GAD共性与差异的关键脑区。
总体而言,本研究是对ALE方法在ID与GAD神经影像学研究中的一次初步探索。未来研究可结合其他基于坐标的元分析方法补充相关性分析,并纳入更多高质量研究,以进一步验证本研究结果,并深入探讨ID与GAD的共同神经影像学机制。
5 结论
本研究识别出ID与GAD在默认模式网络相关脑区中的一致性功能活动改变,主要涉及左侧后扣带回(posterior cingulate cortex,PCC)、左侧楔前叶(precuneus)及左侧内侧前额叶皮层(medial prefrontal cortex,mPFC),提示上述脑区可能构成ID与 GAD的共同神经通路。此外,本研究还发现ID与GAD 在左侧额上回(superior frontal gyrus,SFG)存在差异性激活模式,表明两种障碍可能具有特异性的神经机制。这些发现为未来临床干预与治疗策略的制定提供了潜在的参考依据。
附录 表4 各研究的详细质量评分结果

表5 ID/GAD与健康对照的一级ALE元分析结果
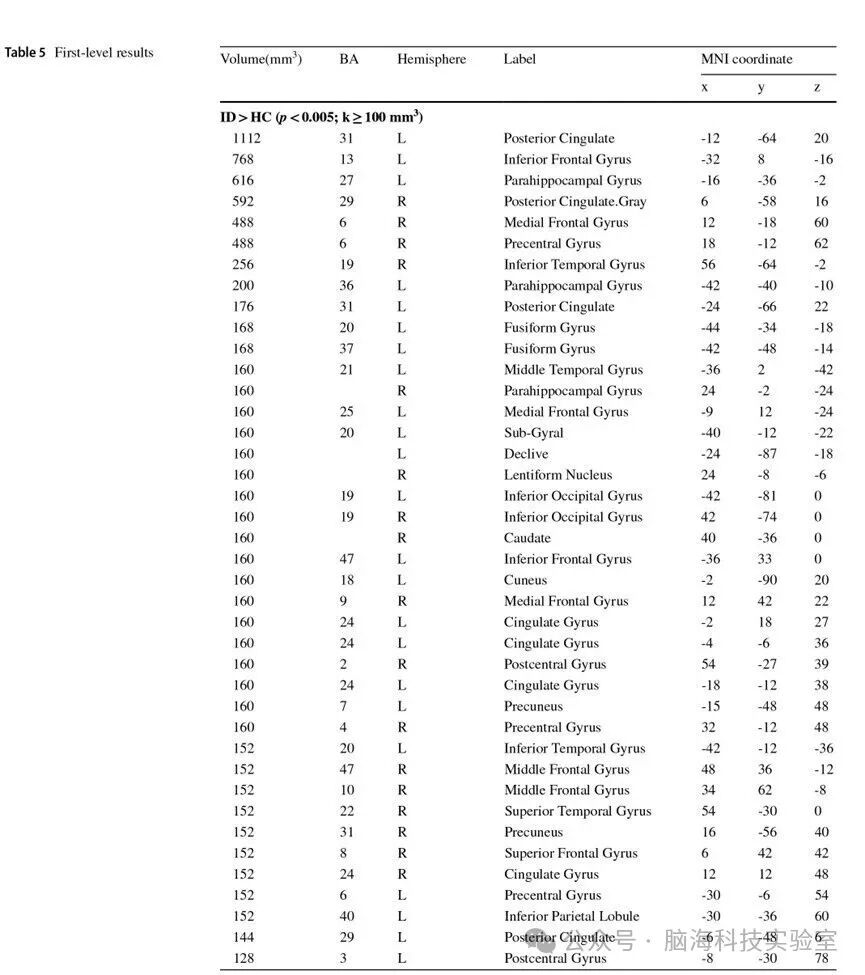

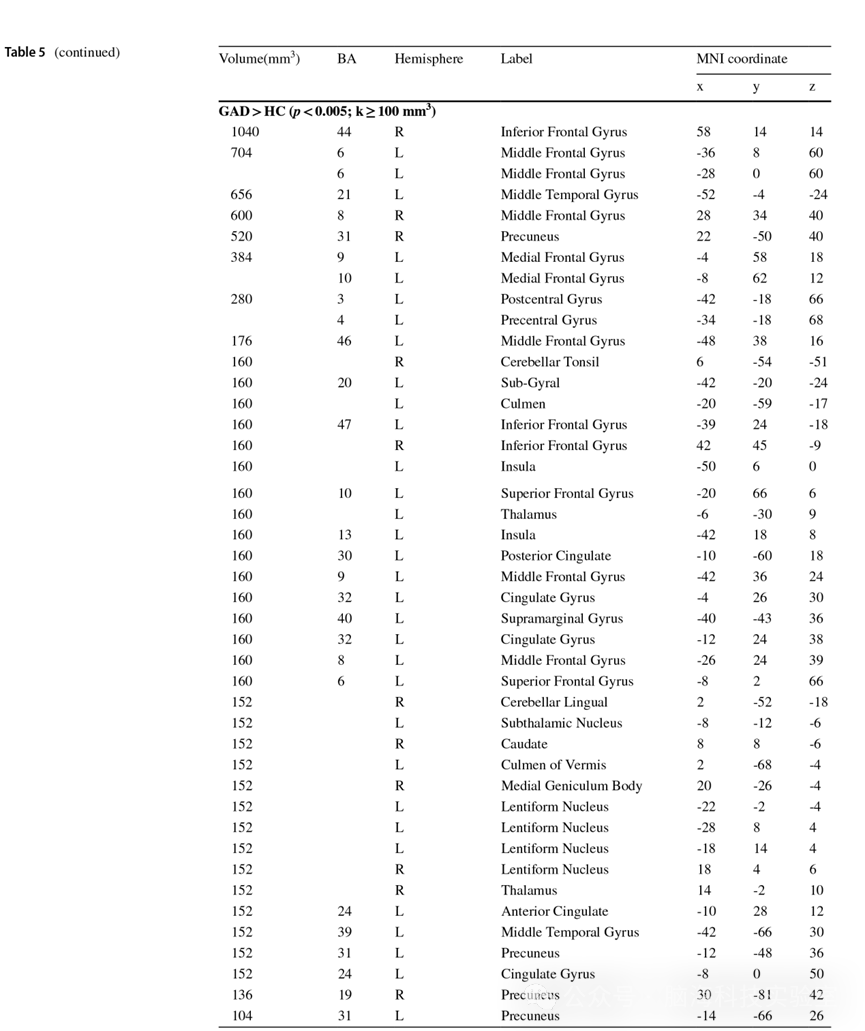

表6 Jackknife 分析

参考文献
Jiang, T., Yin, X., Zhu, L., Wang, G., Zhang, F., & Guo, J. (2025). Comparison of resting-state brain activity between insomnia and generalized anxiety disorder: A coordinate-based meta-analysis. Brain imaging and behavior, 19(1), 218–239. https://doi.org/10.1007/s11682-024-00949-9
更多推荐
 已为社区贡献13条内容
已为社区贡献13条内容








所有评论(0)