【文献阅读】First clinical pregnancy following AI-based microfluidic sperm detection and recovery in
男性因素不育占不育病例的比例高达 40%¹,其中无精子症和隐匿精子症(以射精液中无精子或精子极为罕见为特征的疾病)约占这些病例的 10%-15%²。对于受影响的夫妇而言,诊断和治疗往往涉及多年反复失败的干预措施、侵入性操作以及情感困扰。常规治疗方案通常包括睾丸精子提取术 ³,或由专业胚胎学家进行长时间的人工精子搜寻,随后进行卵胞浆内单精子注射⁴。
男性因素不育占不育病例的比例高达 40%¹,其中无精子症和隐匿精子症(以射精液中无精子或精子极为罕见为特征的疾病)约占这些病例的 10%-15%²。对于受影响的夫妇而言,诊断和治疗往往涉及多年反复失败的干预措施、侵入性操作以及情感困扰。常规治疗方案通常包括睾丸精子提取术 ³,或由专业胚胎学家进行长时间的人工精子搜寻,随后进行卵胞浆内单精子注射⁴。
这些方法具有侵入性、耗时久的特点,且成功率往往较低,许多夫妇最终会被建议考虑供精或收养。为应对这一重要挑战,我们研发了精子追踪与回收(STAR)系统 —— 这是一种基于人工智能(AI)的微流控平台,能够高速、实时地识别并分离此前被归类为无精子症的精液样本中的罕见精子。该全自动、非侵入性系统的设计目标是,为确诊严重男性因素不育的患者提供实现生物学亲子关系的更多可能。我们在此报告 STAR 系统首次临床应用并成功实现确诊妊娠的案例,这标志着在严重男性因素不育的 AI 引导微流控精子回收领域迈出了里程碑式的一步。
STAR 系统通过人工构建的精液样本和临床收集的无精子症样本进行研发和验证。该系统整合了三大核心组件:高速成像系统、定制设计的 Fusion DTx 微流控芯片(图 A)以及基于深度学习的目标检测模型(附录第 1 页)。这些组件协同工作,能够以每小时 400 微升的速度对精液样本进行连续实时分析,图像捕获和处理速率可达每小时 110 万张。为支持这一性能,我们开发了定制化的图形处理器加速 AI 平台,专门针对超高速图像分析进行了优化。
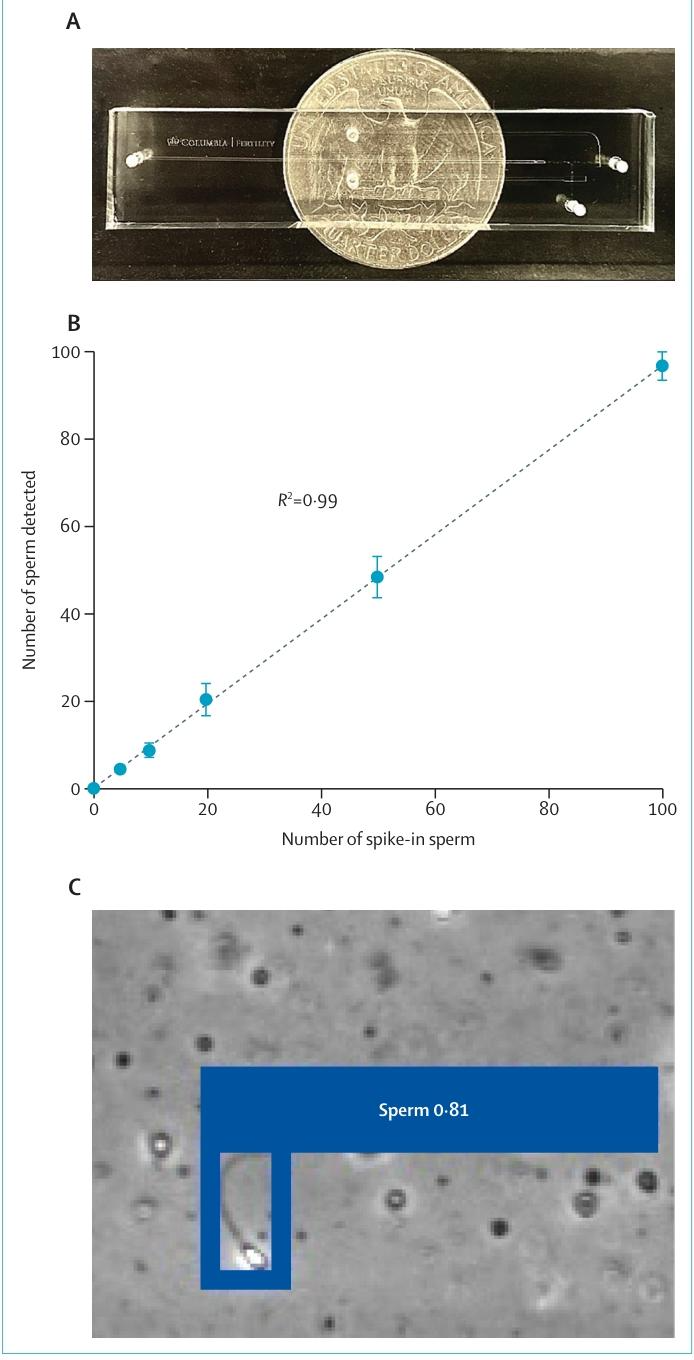
为评估检测准确性,我们向无精子症样本中添加了已知数量的精子(每 400 微升 5-100 个)。结果显示,STAR 系统检测到的精子数量与添加的精子数量具有极佳的线性相关性(R²=0.99;图 B)。当样本流经芯片的微通道时,成像系统以每秒 300 帧的速度连续捕获相差图像(视频)。一个基于内部标注精子图像构建并优化的定制训练目标检测模型,会对每一帧图像进行实时处理。该模型基于 “You Only Look Once” 架构⁵,将每一帧图像划分为网格,通过单次扫描即可预测精子候选目标的边界框和置信度得分(图 C)。
测试结果显示,该模型的精确率为 0.89、召回率为 0.90;在交并比(IoU)阈值为 0.5 时,平均精度均值(mAP)为 0.95,而在交并比阈值 0.5-0.95 的范围内,平均精度均值为 0.60,表明其具备出色的检测准确性。为进一步提升系统稳健性,我们研发了时间一致性过滤器:系统不会依赖单帧图像的判断,而是在目标经过感兴趣区域时,对其连续约 10 帧图像进行追踪,仅当该目标在至少 3 帧图像中被识别为精子时,才确认阳性检测结果。一旦识别到精子,微流控门控机制会将其分离至 300 纳升的体积中。运行结束后,所有分选后的精子会被转移至胚胎实验室,用于卵胞浆内单精子注射(附录第 2 页)。所有流体组件均为一次性使用,确保了无菌性并消除了交叉污染风险。STAR系统采用全封闭的闭环设计,可最大限度减少环境暴露,提升生物安全性。
在此,我们报告 STAR 系统的首次完整临床应用案例。该夫妇有 19 年不孕史。39 岁的男性配偶接受了全面的生殖泌尿外科评估,结果显示其染色体核型正常,无 Y 染色体微缺失,血清睾酮及促卵泡激素水平正常;阴囊超声检查提示双侧睾丸萎缩伴微石症,未发现精索静脉曲张迹象。此前,他曾接受过多次大范围人工精子搜寻及两次睾丸精子提取术,但仅回收得到极少量精子。其 37 岁的女性配偶存在严重卵巢储备功能减退(抗穆勒氏管激素水平为 0.17 纳克 / 毫升)。在过去 11 年间,她已在 4 家生殖中心接受了 19 个取卵周期,其中因精子供应不足,还进行了多个冻卵周期。尽管部分周期尝试了卵胞浆内单精子注射,但受精率始终偏低,此前仅获得 1 枚适合移植的胚胎,且移植后未成功妊娠。
研究团队采集了 3.5 毫升射出精液样本,经温和洗涤后悬浮于 800 微升精液分析缓冲液中,随后采用 STAR 系统进行处理。经人工涂片检查未发现精子;相比之下,STAR 系统在约 2 小时内分析了 250 万张图像,成功检测到 7 枚精子,其中 2 枚为活动精子,5 枚为不活动精子。研究人员将活动精子注入 2 枚成熟卵母细胞(1 枚新鲜获取,1 枚解冻复苏),两枚卵母细胞均发育为卵裂期胚胎。另外 2 枚解冻卵母细胞经不活动精子注射后,未继续发育。两枚存活胚胎于第 3 天进行移植(详见附录第 2 页)。移植后 13 天,患者接受妊娠检测,结果首次呈阳性,后续进展为确诊临床妊娠。在妊娠 8 周时,患者转入产科进行常规产检,超声检查显示胎儿发育正常,心率为 172 次 / 分钟(详见附录第 2 页)。患者转入产科接受后续护理,超声检查显示胎儿发育正常,心率为 172 次 / 分钟(详见附录第 2 页)。
针对严重男性因素不育(包括无精子症和隐匿精子症)的传统精子获取方法,往往具有侵入性、依赖操作者经验且成功率偏低的特点。实时人工智能与精准微流控技术的融合,为临床提供了一种具有前景的非侵入性替代方案。在本概念验证案例中,STAR 系统成功为一对经历近 20 年治疗失败的夫妇获取了有活力的精子,并实现了成功受精。尽管此前已通过 STAR 系统在其他无精子症患者中成功回收并冷冻保存过精子,但本案例是首次将此类精子直接用于受精并达成临床妊娠。据我们所知,这是首份报道的通过人工智能引导微流控平台识别并回收精子,进而实现受精妊娠的临床案例。
尽管研究结果基于单一案例,但仍证实了该技术的可行性,并表明其有望突破生殖医学领域长期存在的技术壁垒。目前,更大规模的临床研究正在进行中,以评估该技术在更广泛患者群体中的可重复性、疗效及临床结局。本案例标志着一项重要进展,凸显了人工智能引导微流控技术在拓展生育护理边界、为既往难治性不育患者重拾希望方面的变革性潜力。
研究设计与方法由 HS 和 ZW 构思制定。HS 负责软件开发、可视化呈现、正式数据分析及数据整理工作;SM 和 EJF 负责研究资源保障;ZW 负责资金筹集;LCG、SM、GK、RWP 及 RF 实施了相关研究调查;LCG 撰写了论文初稿;HS、EJF 及 ZW 对论文进行了编辑审阅,并负责研究的整体监督;EJF 和 SM 负责研究资源协调及临床数据的获取与验证;HS 和 LCG 负责 STAR 系统相关数据的获取与验证。所有作者均能全面获取本研究的所有数据,并对论文是否投稿发表拥有最终决策权。HS 和 ZW 声明为哥伦比亚大学就该技术提交的相关专利申请的发明人。
该专利申请由哥伦比亚大学就相关技术提交。其他所有作者均声明无利益冲突。本通信所依据的去标识化技术数据及影像数据,可在符合机构审查规定及患者隐私保护条例的前提下,经合理请求向通讯作者获取。鉴于本报告为单病例研究性质,个体层面的临床数据暂不对外公开。本研究得到黑文斯创新基金(Havens Innovation Fund)资助。
赫曼特・苏里亚万希(Hemant Suryawanshi)、劳拉・C・杰梅尔(Laura C Gemmell)、斯蒂芬妮・摩根(Stephanie Morgan)、乔治・库斯塔斯(George Koustas)、罗伯特・W・普罗斯瑟(Robert W Prosser)、瑞安・傅(Ryan Fu)、埃里克・J・福尔曼(Eric J Forman)、* 泽夫・威廉姆斯(Zev Williams)电子邮箱:zw2421@cumc.columbia.edu美国纽约州纽约市 10019 号,哥伦比亚大学医学中心妇产科,哥伦比亚大学生殖中心
参考文献:
- 库马尔(Kumar N)、辛格(Singh AK). 男性因素不育 —— 不孕的重要成因之研究趋势综述 [J]. 人类生殖科学杂志(J Hum Reprod Sci), 2015, 8: 191-196.
- 沃斯尼策(Wosnitzer M)、戈德斯坦(Goldstein M)、哈迪(Hardy MP). 无精子症研究综述 [J]. 精子发生(Spermatogenesis), 2014, 4: e28218.
- 施莱格尔(Schlegel PN). 睾丸精子提取术:显微切割技术在最小组织切除前提下提高精子获取率 [J]. 人类生殖(Hum Reprod), 1999, 14: 131-135.
- 帕勒莫(Palermo G)、约里斯(Joris H)、德夫鲁瓦(Devroey P)、范・斯泰尔特赫姆(Van Steirteghem AC). 单精子卵胞浆内注射后的妊娠结局 [J]. 柳叶刀(Lancet), 1992, 340: 17-18.
- 瓦尔盖塞(Varghese R)、桑巴斯(Sambath M). YOLOv8:一种性能与稳健性均增强的新型目标检测算法 [C]//2024 年数据工程与智能计算系统进展国际会议(ADICS)论文集,2024 年 4 月 18-19 日: 1-6.
更多推荐
 已为社区贡献13条内容
已为社区贡献13条内容






所有评论(0)