下一代药物研发NGDD
人工智能(AI)与药物发现流程的融合,正通过提升效率、预测准确性和创新能力,重新定义制药研究。传统药物研发受高成本、长周期和低成功率的限制,而深度学习、预测建模和可解释人工智能(XAI)正推动其转型。这些工具能够高通量解读涵盖基因组学、蛋白质组学和代谢组学的多组学数据集,从而加速靶点识别、先导化合物优化和药物重定位。包括变分自编码器(VAEs)、生成对抗网络(GANs)和基于 Transforme
摘要
人工智能(AI)与药物发现流程的融合,正通过提升效率、预测准确性和创新能力,重新定义制药研究。传统药物研发受高成本、长周期和低成功率的限制,而深度学习、预测建模和可解释人工智能(XAI)正推动其转型。这些工具能够高通量解读涵盖基因组学、蛋白质组学和代谢组学的多组学数据集,从而加速靶点识别、先导化合物优化和药物重定位。包括变分自编码器(VAEs)、生成对抗网络(GANs)和基于 Transformer 的架构在内的生成模型,支持生物活性化合物的从头设计,而强化学习则可优化分子属性。图神经网络(GNNs)和卷积神经网络(CNNs)推动了基于结构的药物设计发展,提升了虚拟筛选和结合亲和力预测的效果。AI 与量子化学的结合增强了分子属性估算能力,减少了对实验验证的依赖。AI驱动的药物-靶点相互作用(DTIs)预测既为药物重定位提供支持,也助力药物警戒工作。本综述提出了1个兼顾多靶点药理学的「发现反馈」框架,将生物标志物、分子亚型和通路约束等转化信号重新整合到靶点选择和化合物优化中,以提升决策质量。与以往聚焦单一AI应用的综述不同,本文提供了从靶点发现到监管转化的端到端统一综述。区分了2类模型:❶ 学习可迁移分子表征的基础模型,❷ 合成新化合物的生成模型。这些进展与多模态学习、可解释人工智能以及连接分子设计与自动化合成的「设计-制备-测试-学习」闭环系统相结合,勾勒出1条基于机制的AI驱动药物发现路线图,适用于现代制药全流程。
#药物发现 #深度学习 #预测建模 #可解释人工智能 #基于结构的药物设计 #药物靶点相互作用
引言
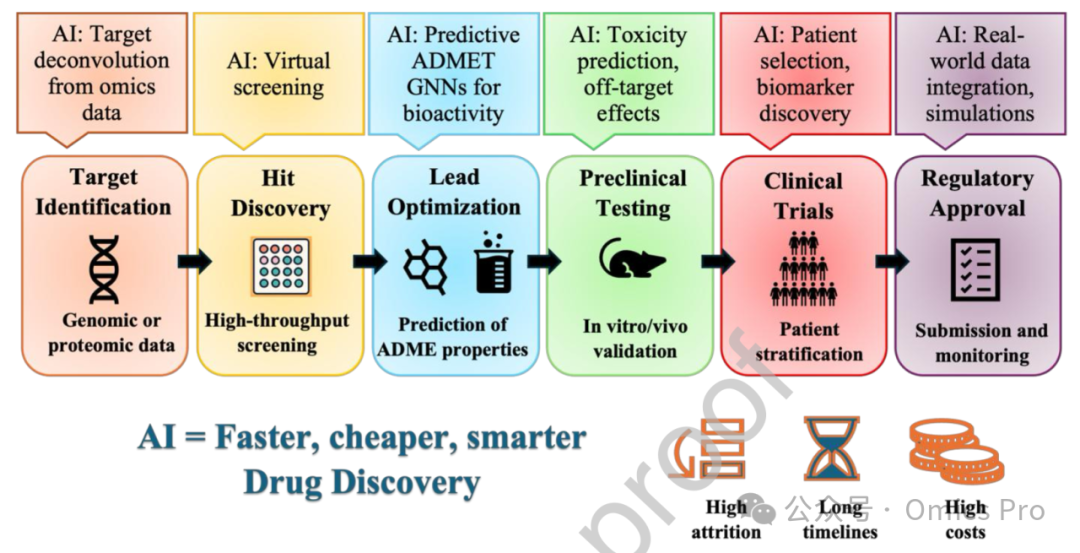
图1 药物发现全流程中的人工智能应用
概述人工智能在药物发现各阶段的作用,包括靶点识别、苗头化合物发现、先导化合物优化、临床前测试、临床开发和监管评估,每个阶段均具备针对性功能,如多组学驱动的靶点 / 生物标志物推断、虚拟筛选、ADMET 预测、患者分层和证据整合
人工智能驱动的分子设计
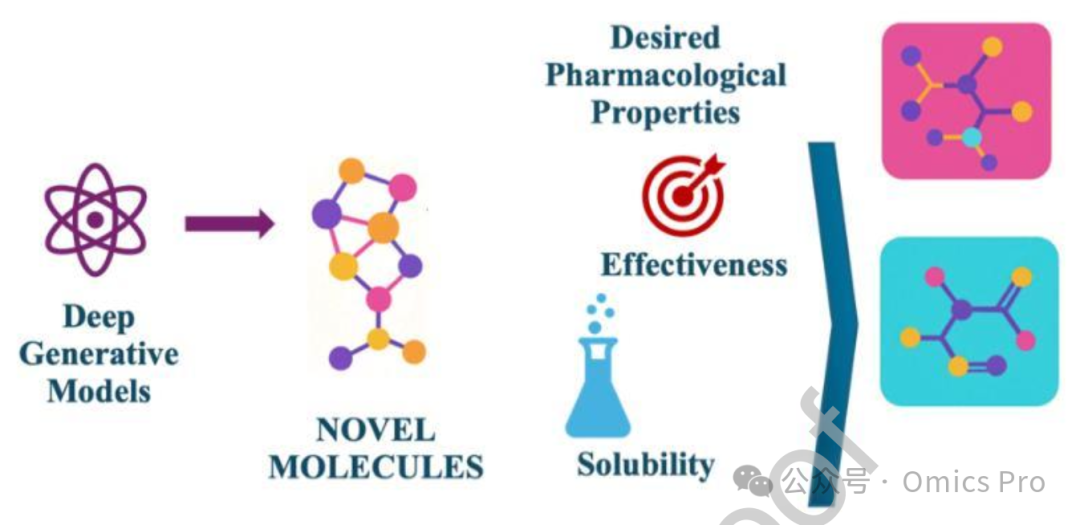
图2 生成模型与从头药物设计
示意图解生成模型如何应用于从头药物设计,以创造具有所需特性的新型分子结构
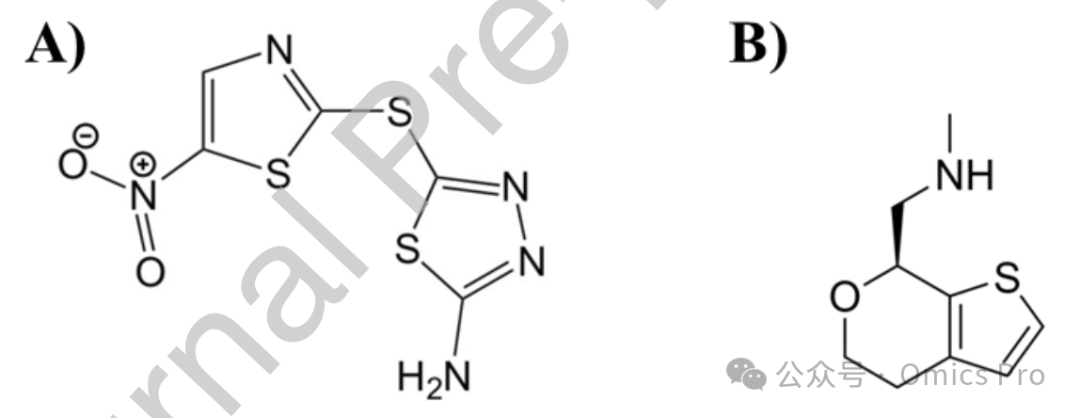
图3 A)哈立辛和 B)乌洛他隆(SEP-363856)的2维化学结构
展示2个知名 AI 发现或 AI 辅助的药物候选物的化学结构:前者最初为糖尿病药物,通过深度学习模型重定位用于抗菌活性;后者是通过 AI 驱动的表型筛选确定的新型精神药物
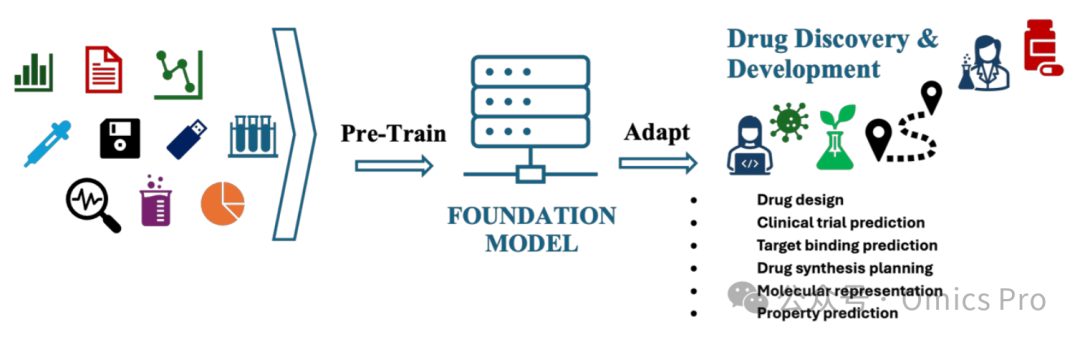
图4 药物发现中的基础模型
基础模型将多种生物医学、化学和分子数据源整合为统一的潜在表征,这些大规模架构可捕捉可迁移知识,适配药物发现全流程的多个下游任务,从靶点识别、化合物优化到临床前验证和临床转化
智能化学:计算药物设计中的人工智能
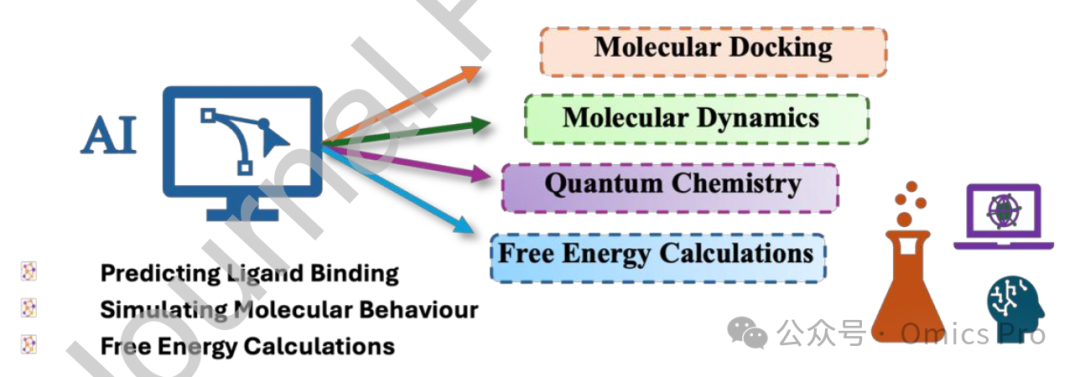
图5 智能化学:计算药物设计流程中的人工智能应用
图示人工智能如何融入计算药物设计流程,支持从分子对接、分子动力学模拟、量子化学计算到自由能计算的每个阶段,加速整体发现过程
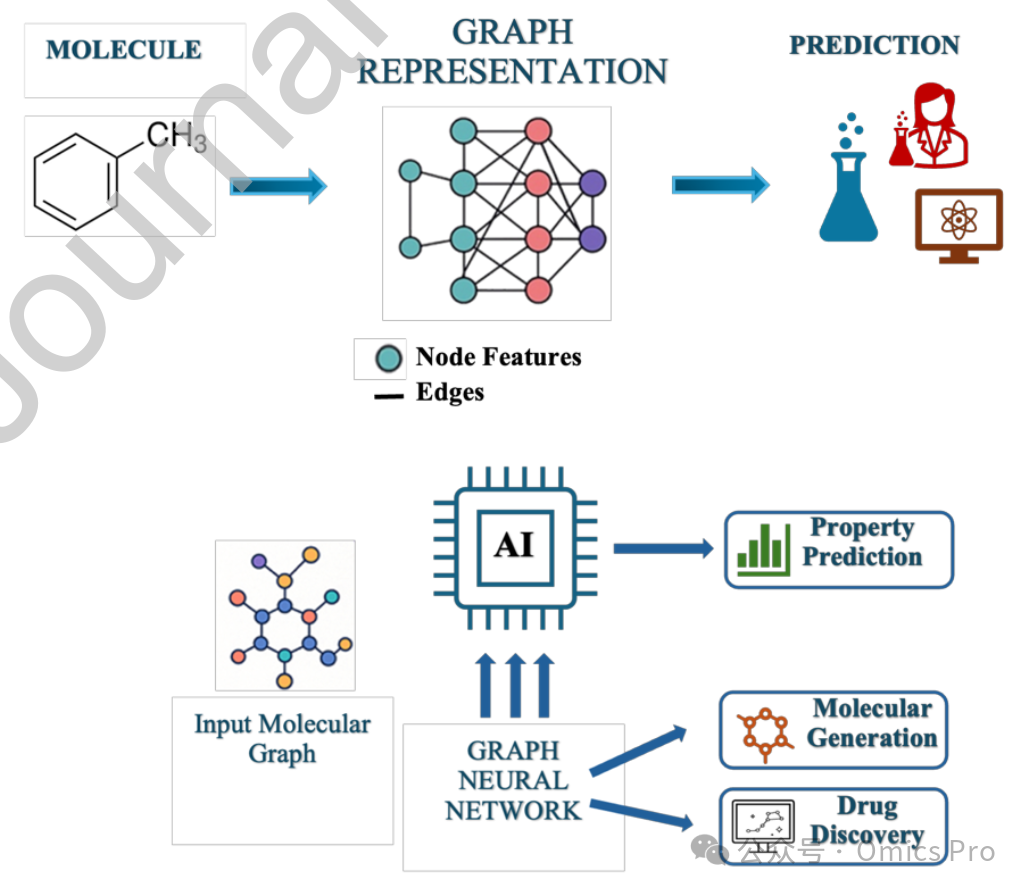
图6 图与图神经网络
展示分子结构如何表示为图——原子作为节点、化学键作为边,以及用于处理这些表征的神经网络示意图;该图神经网络通过聚合相邻原子的信息,预测化学性质、生物活性和药物 - 靶点相互作用,是现代 AI 驱动分子建模的核心框架
从生成模型到基础架构:药物发现中人工智能范式的比较评估
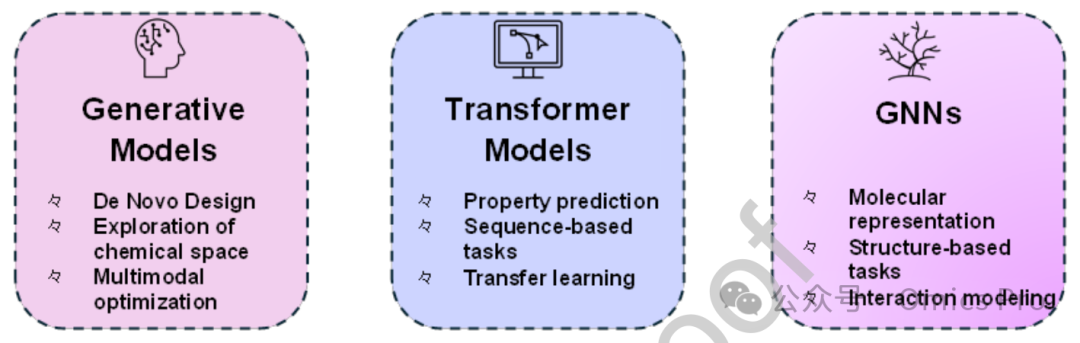
图7 药物发现中各类人工智能方法的比较
对比药物发现中使用的多种人工智能方法,突出其关键特性
人工智能与监管转化:迈向实际应用
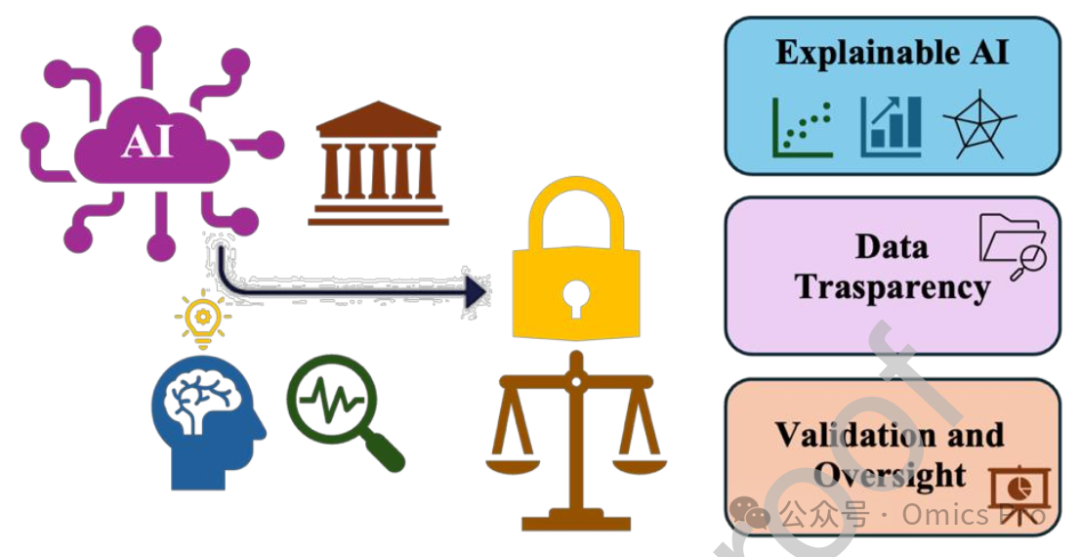
图8 药物发现中的人工智能与监管转化
图示人工智能工具如何协助将监管要求转化为药物发现流程,提高合规性并加速开发周期,核心包含可解释人工智能、数据透明度、验证与监督3大维度
人工智能驱动药物发现的案例研究
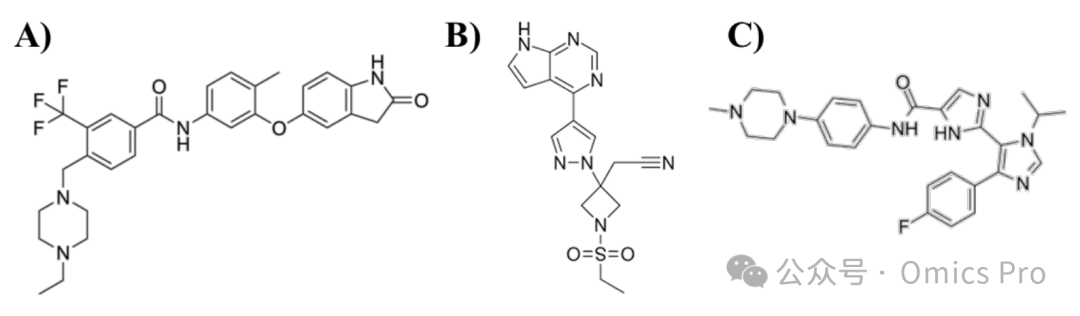
图9 A)DDR1 抑制剂、B)巴瑞替尼、C)INS018_055 的2维化学结构
展示3种具有潜在治疗作用的化合物的分子结构
详细总结
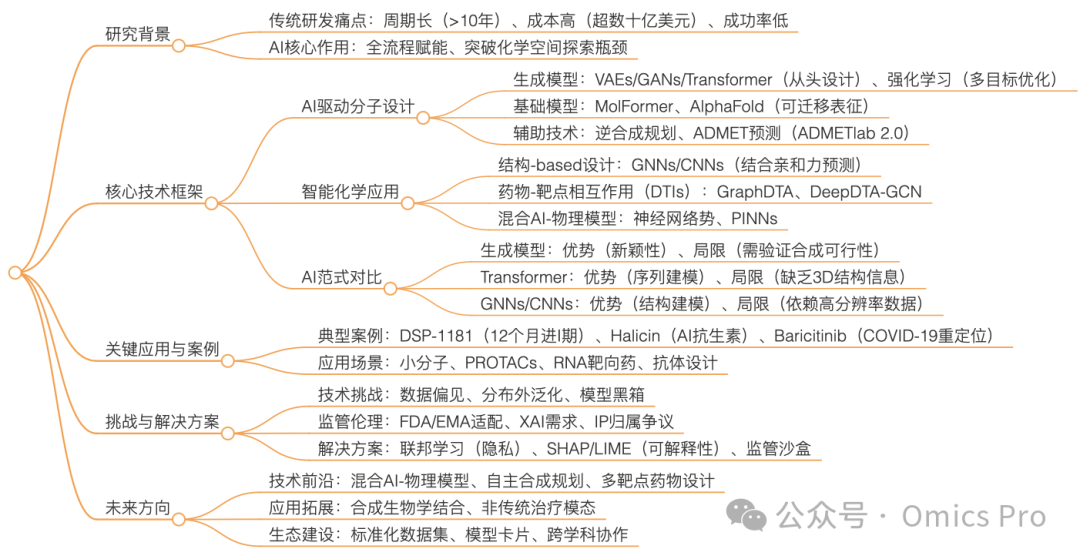
思维导图(mindmap脑图)
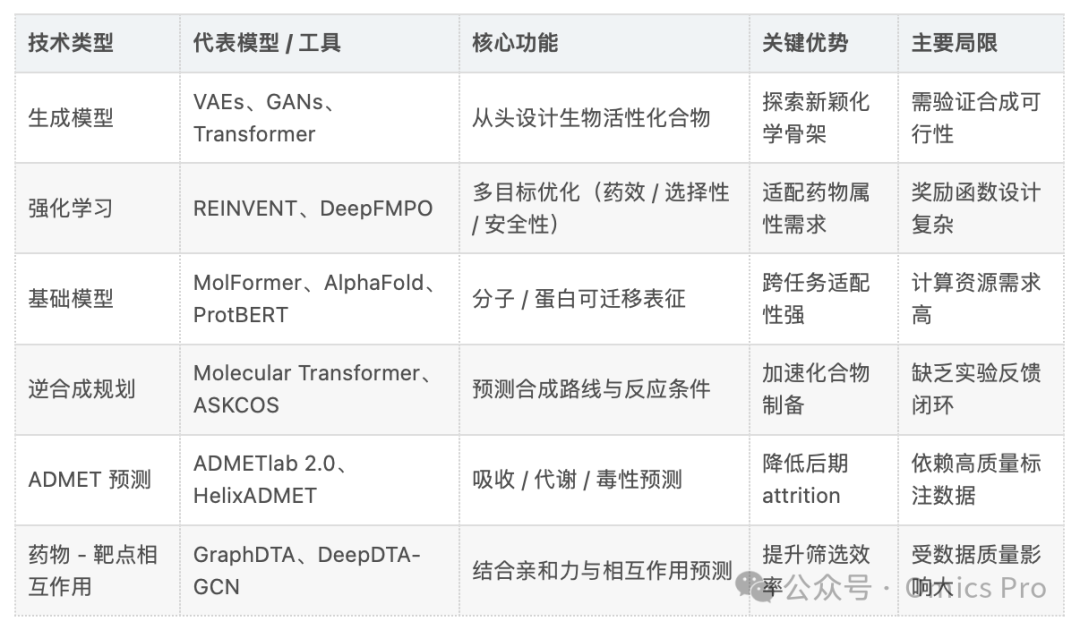
核心技术:AI驱动药物发现的方法论与工具
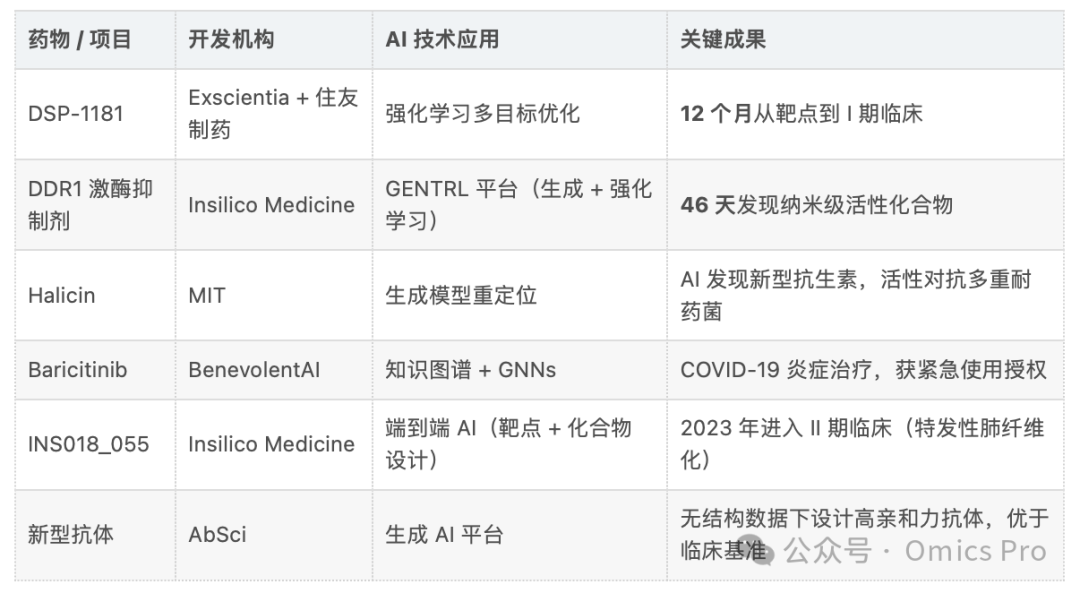
应用案例:AI驱动药物发现的落地成效
参考
Next-generation drug discovery: The AI revolution in pharmaceutical research
https://doi.org/10.1016/j.ailsci.2025.100149
注:AI辅助创作,如有错误欢迎指出。内容仅供参考,不构成任何建议。
更多推荐
 已为社区贡献4条内容
已为社区贡献4条内容







所有评论(0)