【NeurIPS 2024+Nature 2025]揭开“隐形”肿瘤的面纱:AI + 物理模型,开启胶质母细胞瘤精准治疗新篇章
当 AI 掌握了物理规律,它就能穿透影像的迷雾,预见未来的复发风险。该方法不仅局限于脑肿瘤,还可以扩展到其他受刚性物理模型限制的现实世界问题中。目前,该项目的代码已在GitHub 开源,研究团队希望通过技术共享,加速这一工具向临床转化的进程。项目地址。
在神经肿瘤学领域,胶质母细胞瘤(GBM)因其极强的浸润性被称为“最难对付的敌人”。虽然MRI影像能看到肿瘤核心,但那些悄悄向四周扩散的低浓度肿瘤细胞却如同“隐形”一般,躲过了影像检查,也成为了手术和放疗后的复发根源。来自苏黎世大学、慕尼黑工业大学和哈佛大学等机构的研究团队在顶级 AI 会议 NeurIPS 2024 上(Physics-regularized multi-modal image assimilation for brain tumor localization)发表了一项突破性研究,在2025年Nature上(Individualizing glioma radiotherapy planning by optimization of a data and physics-informed discrete loss),他们继续提出了一种名为 GliODIL 的创新框架,通过将生物物理定律与多模态影像数据深度融合,精准推断全脑肿瘤细胞的完整分布,为个性化放疗规划提供了强有力的科学依据。
该研究放弃了传统的纯数据驱动模型(大规模神经网络等),通过物理正则化多模态图像同化技术,首次将生物生长动力学与超弹性力学模型深度集成,实现了对全脑肿瘤细胞分布的精准推断。


下面是我用AI绘制的论文概览图
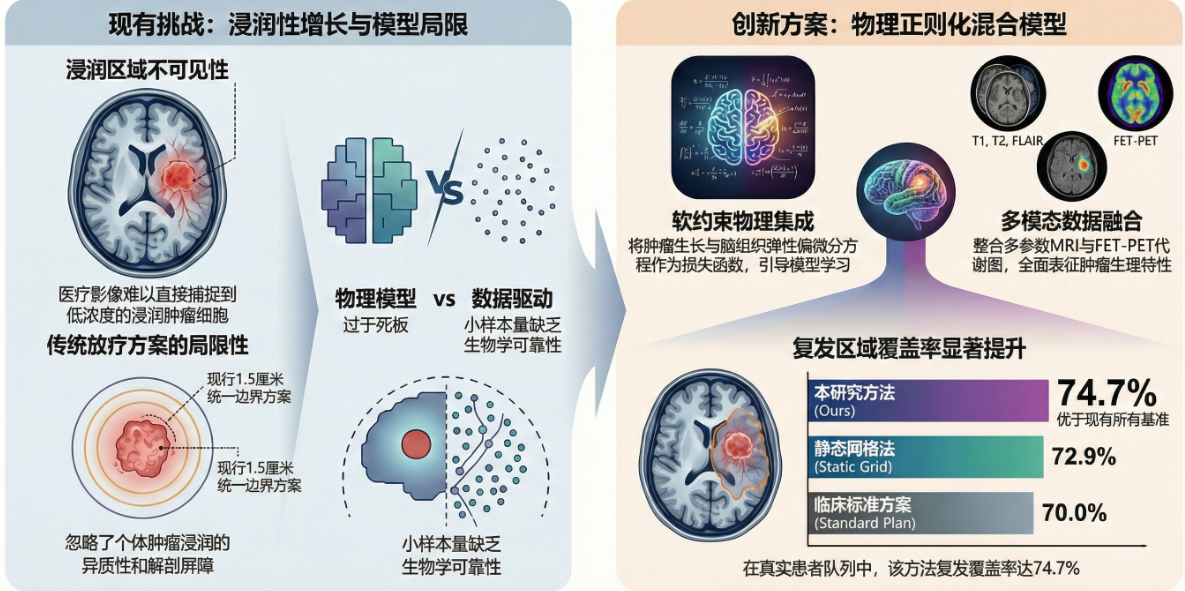
1. 临床痛点:影像之外的“盲区”
目前,临床医生在为 GBM 患者制定放射治疗(放疗)计划时,通常会在 MRI 显示的肿瘤核心基础上,统一向外扩大 1.5 厘米 的安全边缘。
然而,这种“一刀切”的方案忽略了每个患者大脑解剖结构的差异,也无法反映肿瘤在不同脑组织(如白质与灰质)中截然不同的扩散速度。其后果是:
• 覆盖不足:部分浸润区域被漏掉,导致肿瘤在边缘外复发。
• 过度照射:损伤了本不该受辐射的健康脑组织。
2.生物物理建模:从“黑盒”回归第一性原理
传统深度学习(如 CNN)在医疗小样本数据上极易过拟合,且缺乏可解释性。本文的核心突破在于构建了一套严谨的**生物物理偏微分方程(PDE)**来描述肿瘤的演化过程:
1. 反应-扩散-对流生长模型 (Reaction-Diffusion-Advection)
为了描述肿瘤细胞在脑组织中的复杂迁移,研究者使用了如下控制方程:
∂c∂t=∇⋅(D(m)∇c)⏟细胞扩散+ρc(1−c)⏟逻辑增长−∇⋅(vc)⏟组织位移导致的对流\frac{\partial c}{\partial t}=\underbrace{\nabla\cdot(D(m)\nabla c)}_\text{细胞扩散}+\underbrace{\rho c(1-c)}_\text{逻辑增长}-\underbrace{\nabla\cdot(vc)}_\text{组织位移导致的对流}∂t∂c=细胞扩散 ∇⋅(D(m)∇c)+逻辑增长 ρc(1−c)−组织位移导致的对流 ∇⋅(vc)
扩散项:考虑了白质与灰质不同的扩散率 D(m)D(m)D(m),模拟肿瘤沿神经纤维的偏好扩散。
• 对流项:引入速度场vvv,刻画肿瘤扩张对周围组织产生的物理推移。
2. Neo-Hookean 超弹性力学约束
大尺寸肿瘤会产生明显的占位效应(Mass Effect)。模型引入了基于 Neo-Hookean 模型的超弹性应力张量 σ\sigmaσ,通过准静态力学平衡方程确保组织形变的物理合理性。
∇⋅σ(u)+γ∇c=0\nabla\cdot\sigma(u)+\gamma\nabla c=0∇⋅σ(u)+γ∇c=0
方程将肿瘤浓度梯度(∇c\nabla c∇c)作为驱动力,通过可学习参数 γ\gammaγ 耦合了生物生长与机械形变。
3.核心算法:ODIL 框架下的损失函数优化
不同于物理信息神经网络(PINNs)优化 MLP 权重,本文采用 ODIL(离散损失优化) 框架,直接在 1.5 亿个时空离散网格点上优化未知场。其总损失函数LTotalL_{Total}LTotal构成了模型学习的“指挥棒”。
LTotal=α1LGrowth+α2LElasticity⏟物理假设+α3LGaussian+α4LHealthy⏟初始假设+α5LImaging⏟影像重建L_{Total}=\underbrace{\alpha_1L_{Growth}+\alpha_2L_{Elasticity}}_{\text{物理假设}}+\underbrace{\alpha_3L_{Gaussian}+\alpha_4L_{Healthy}}_{\text{初始假设}}+\underbrace{\alpha_5L_{Imaging}}_{\text{影像重建}}LTotal=物理假设 α1LGrowth+α2LElasticity+初始假设 α3LGaussian+α4LHealthy+影像重建 α5LImaging
物理假设项(Physical Assumptions):利用隐式欧拉方案和粒子-网格投影(Particle-Grid Projections),计算动力学残差,确保时空演化符合上述 PDE。
健康解剖约束(Healthy Anatomy):利用大脑的近似对称性来约束肿瘤发生前的初始状态,实现对患者“未患病时”原始解剖结构的逆向推断。
多模态影像对齐(Imaging Data Reconstruction):
◦ LCore/LEdemaL_{Core}/L_{Edema}LCore/LEdema:通过 Sigmoid 阈值函数将预测浓度与 MRI 观测到的核心及水肿区对齐。
◦ LMetabolicL_{Metabolic}LMetabolic:引入 FET-PET 代谢图,通过皮尔逊相关系数(Pearson correlation)约束高代谢活跃区的细胞密度
4.核心突破:让物理规律为 AI “导航”
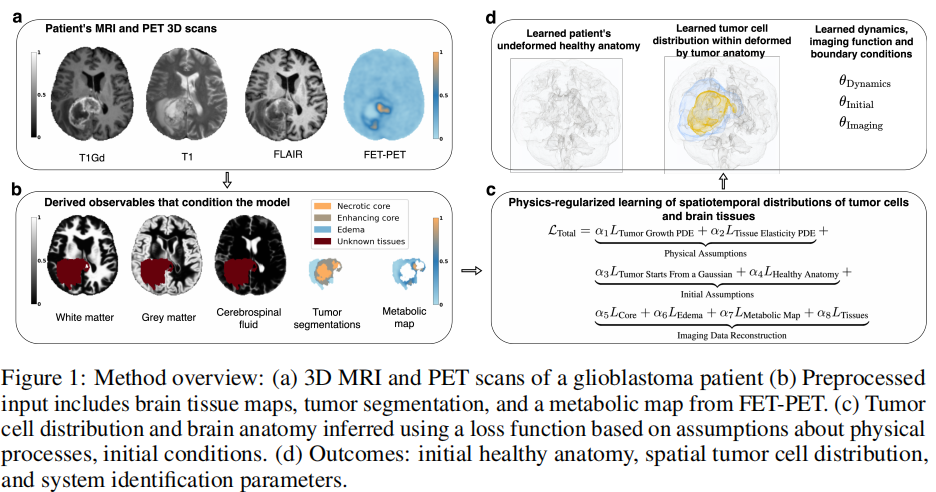
传统的深度学习方法由于缺乏高质量的“真值”数据(无法获取全脑切片观察细胞分布),在预测肿瘤浸润方面一直表现平平。
本研究另辟蹊径,采用了**物理正则化学习(Physics-regularized learning)**策略,其核心名为 ODIL(离散损失优化)。不同于普通的神经网络,该框架直接在离散网格上进行优化,并将复杂的生物物理方程转化为“软约束”:
- 肿瘤生长方程:模拟细胞的扩散迁移和增殖逻辑。
- 组织弹性模型:首次在混合学习框架中引入 Neo-Hookean 超弹性力学模型,模拟肿瘤生长对周围大脑组织产生的挤压(占位效应)。
- 多模态数据同化:除了常规的 MRI(T1, T1Gd, FLAIR),还引入了 FET-PET 代谢图,利用代谢信息进一步锁定活跃的肿瘤细胞。
本文提出的方法不仅仅是为了简单的“定位”肿瘤位置,其核心目标是推断患者特有的全脑肿瘤细胞空间分布(Full spatial tumor cell distribution),并以此解决临床上“看不见的肿瘤浸润”问题。
5.逆向思维:推断“病发前”的健康大脑
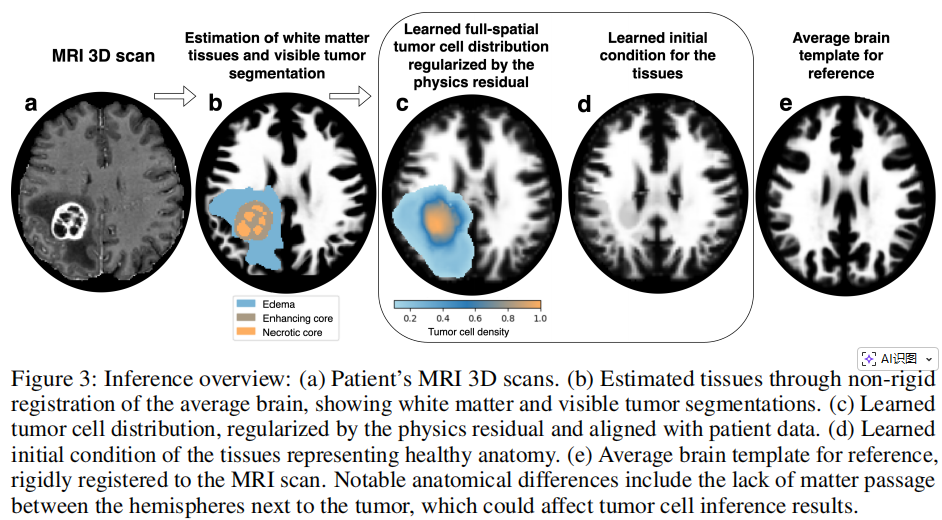
该模型最惊艳的功能之一是能够**“时光倒流”。通过学习肿瘤生长产生的形变过程,模型可以反向推断出患者在肿瘤发生前的初始健康解剖结构**。
这种“健康底图”的还原,不仅有助于模型更准确地计算肿瘤的扩散路径,还能帮助医生评估手术切除的程度以及术后大脑的受压恢复情况。
6.实验验证:捕捉复发的“预言家”
研究团队在包含 58 名患者的临床数据集上进行了验证。结果显示,在保持总放疗体积相同的情况下:
复发覆盖率大幅提升:对于后续随访中出现的肿瘤复发区域,新方法的覆盖率达到了 77.00%(针对所有复发区)和 89.9%(针对增强核心复发区),显著优于目前的临床标准(62.33%)和其他前沿模型。
更强的鲁棒性:即使在缺乏 PET 影像的情况下,模型依然能通过物理正则化保持稳健的表现。
7.结语与开源
这项研究证明了:当 AI 掌握了物理规律,它就能穿透影像的迷雾,预见未来的复发风险。 该方法不仅局限于脑肿瘤,还可以扩展到其他受刚性物理模型限制的现实世界问题中。
目前,该项目的代码已在 GitHub 开源,研究团队希望通过技术共享,加速这一工具向临床转化的进程。
项目地址:https://github.com/m1balcerak/PhysRegTumor
更多推荐
 已为社区贡献14条内容
已为社区贡献14条内容






所有评论(0)