β-Endorphin (rat) ;YGGGFMTSEKSQTPLVTLFKNAAIIKNVHKKGQ
该肽段的生物活性基于。
·
一、基础性质
- 英文名称:β-Endorphin (rat);Rat β-Endorphin;Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys-Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu-Phe-Lys-Asn-Ala-Ile-Ile-Lys-Asn-Val-His-Lys-Lys-Gly-Gln Peptide
- 中文名称:大鼠 β- 内啡肽;31 肽大鼠内源性阿片肽;β- 促脂素 C 端阿片活性片段
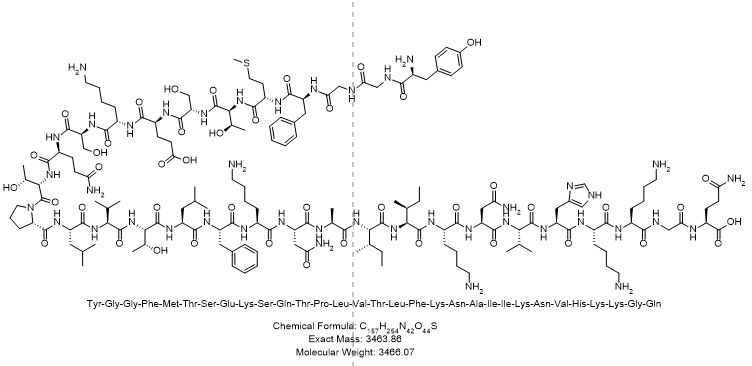
- 多肽序列:H-Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys-Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu-Phe-Lys-Asn-Ala-Ile-Ile-Lys-Asn-Val-His-Lys-Lys-Gly-Gln-OH
- 单字母序列:H-YGGGFMTSEKSQTPLVTLFKNAAIIKNVHKKGQ-OH
- 等电点(pI):理论值 9.5-10.0
- 分子量:约3466.07 Da
- 分子式:C157H254N42O44S
- 外观与溶解性:白色粉末,纯度≥98%;易溶于水、PBS 缓冲液(pH 7.0-7.4)、Tris-HCl 缓冲液,微溶于甲醇、乙醇,不溶于氯仿、乙醚等非极性溶剂;水溶液浓度达 2 mg/mL 时无聚集、无浑浊,稳定性良好。
- 稳定性:-20℃干燥避光条件下可保存 24 个月以上;水溶液在 4℃下稳定 5 天,37℃生理条件下半衰期约 4 小时;序列中的 Met 残基易被氧化,碱性氨基酸(Lys/His)易发生脱氨基反应,长期储存需添加抗氧化剂(如 DTT)并控制 pH;长肽链结构使其易被内肽酶降解,体内半衰期短于短链阿片肽(如脑啡肽类似物)。
- 结构式:
二、核心生物活性与作用机理
1. 核心生物活性
大鼠 β- 内啡肽通过高亲和力激活 MOR 及部分激活 DOR,发挥多维度生物学功能,具体表现为:
- 强效镇痛作用:镇痛活性显著高于甲硫氨酸脑啡肽,通过激活中枢神经系统(中脑导水管周围灰质、脊髓背角、丘脑)的 MOR,抑制伤害性信号的产生与传递,对急性痛、慢性炎性痛和神经病理性痛均有显著缓解效果;镇痛作用持续时间长于短链阿片肽,且在治疗剂量下成瘾性潜力低于吗啡。
- 情绪调节功能:通过激活大脑边缘系统(杏仁核、海马、伏隔核)的 MOR 和 DOR,调节多巴胺、5 - 羟色胺神经递质的释放,发挥显著的抗焦虑、抗抑郁样作用;在大鼠强迫游泳实验、高架十字迷宫实验中,中枢给予该肽段可显著改善应激诱导的情绪异常。
- 食欲调控作用:通过激活下丘脑弓状核的 MOR,促进食欲相关神经元(如 AgRP 神经元)的活性,显著增加食物摄入量;同时抑制能量消耗相关通路,在大鼠模型中可诱导剂量依赖性的体重增加,是神经内分泌调控食欲的核心内源性分子。
- 免疫调节活性:通过激活免疫细胞(淋巴细胞、巨噬细胞)表面的阿片受体,抑制促炎细胞因子(TNF-α、IL-1β、IL-6)的释放,促进抗炎细胞因子(IL-10)的分泌,参与免疫稳态的维持;在大鼠脓毒症模型中,可减轻全身炎症反应,降低器官损伤程度。
- 神经保护功能:在大鼠脑缺血、帕金森病模型中,通过激活中枢 DOR,抑制神经细胞凋亡,减轻氧化应激和炎症反应,保护血脑屏障完整性,改善神经功能缺损;作用强度与脑源性神经营养因子(BDNF)相当。
2. 作用机理
该肽段的生物活性基于与阿片受体的特异性结合及下游 Gi/o 蛋白介导的信号通路调控,核心机制如下:
- 受体识别与激活
- N 端核心区的 Tyr 残基酚羟基与 MOR 跨膜区的 Asp 残基形成氢键,Phe 的苯环嵌入受体的疏水结合口袋,介导肽段与 MOR 的高特异性结合;C 端碱性区的正电荷与受体胞外区的负电荷氨基酸形成静电相互作用,进一步增强结合亲和力。
- 肽段结合诱导受体构象变化,激活与受体偶联的Gi/o 蛋白(主要),抑制 Gs 蛋白的活性,启动下游信号级联反应。
2.下游信号通路激活与功能介导
- 镇痛作用机制:Gi/o 蛋白激活后,抑制腺苷酸环化酶(AC)活性,降低细胞内 cAMP 水平;同时激活内向整流钾通道(Kir),促进 K⁺外流导致神经元细胞膜超极化,抑制电压门控钙通道(VGCC),减少 Ca²⁺内流;最终抑制脊髓背角伤害性神经元的放电,阻断疼痛信号上行传递至大脑皮层。
- 情绪调节机制:在边缘系统神经元中,cAMP 水平降低可增强多巴胺能神经元的活性,增加伏隔核多巴胺释放,产生愉悦效应;同时激活 DOR 介导的信号通路,促进海马区 5 - 羟色胺的合成与释放,改善焦虑、抑郁情绪。
- 食欲调控机制:下丘脑弓状核的 MOR 激活后,通过抑制腺苷酸环化酶通路,增强 AgRP 神经元的放电频率,促进食欲肽(如神经肽 Y,NPY)的释放,同时抑制厌食肽(如 α- 黑素细胞刺激素,α-MSH)的分泌,最终促进摄食行为。
三、应用领域与原理
1. 主要应用领域
- 大鼠疼痛模型研究:用于急性痛(热板实验、甩尾实验)、慢性炎性痛(角叉菜胶足跖肿胀模型)、神经病理性痛(坐骨神经结扎模型)的机制研究,评估内源性阿片系统在疼痛调控中的作用,是筛选新型镇痛药物的核心工具肽。
- 神经内分泌调控研究:用于探索下丘脑 - 垂体 - 肾上腺轴(HPA 轴)与阿片肽系统的交互作用,解析 β- 内啡肽在应激反应、食欲调控、体重平衡中的分子机制,适用于肥胖、代谢综合征的大鼠模型研究。
- 情绪障碍疾病研究:用于大鼠焦虑症、抑郁症模型的发病机制研究,评估靶向 MOR/DOR 的治疗策略潜力,为抗焦虑、抗抑郁药物开发提供实验依据。
- 阿片受体功能研究:作为 MOR 高选择性激动剂,用于体外受体结合实验、信号通路激活分析及高通量药物筛选模型构建,可与 MOR 拮抗剂(如纳洛酮)联用验证受体依赖性。
2. 应用原理
- 疼痛模型研究原理:在大鼠坐骨神经结扎慢性痛模型中,鞘内注射大鼠 β- 内啡肽(剂量 5 μg/kg)后,检测机械痛阈、热痛阈的变化;通过预先注射纳洛酮(MOR 拮抗剂),验证镇痛作用的受体特异性;同时检测脊髓背角 P 物质、谷氨酸的释放量,明确其在伤害性信号传递中的调控作用。
- 食欲调控研究原理:在大鼠禁食 - 再喂食模型中,侧脑室注射该肽段(剂量 10 μg/kg)后,记录食物摄入量和体重变化;通过检测下丘脑 NPY、α-MSH 的 mRNA 表达水平,解析其调控食欲的分子机制;结合 MOR 敲除大鼠模型,验证作用的特异性。
- 药物筛选应用原理:构建稳定表达 MOR 的 HEK293 细胞系,将大鼠 β- 内啡肽作为阳性对照,与候选化合物共同孵育;通过检测细胞内 cAMP 浓度变化或 β-arrestin 招募水平,评估候选化合物的受体激活活性,实现高通量镇痛药物筛选。
四、研究进展
- 长效类似物开发:对大鼠 β- 内啡肽进行 N 端棕榈酸修饰和 C 端酰胺化修饰,修饰后的肽段体内半衰期从 4 小时延长至 24 小时,血脑屏障穿透效率提升 3 倍;在大鼠慢性痛模型中,镇痛作用持续时间从 6 小时延长至 18 小时,且无明显呼吸抑制副作用。
- 受体选择性优化:通过定点突变 N 端核心区的 Gly 为 D-Ala,得到衍生物 [D-Ala²]- 大鼠 β- 内啡肽,对 MOR 的选择性提升 10 倍,镇痛活性增强 5 倍,且对 DOR 的激活作用显著降低,减少了情绪调节相关的副作用。
- 联合治疗策略探索:研究发现,大鼠 β- 内啡肽与非甾体抗炎药(如布洛芬)联合使用,在大鼠炎性痛模型中可产生协同镇痛效果,药物剂量降低 50%,且胃肠道副作用显著减轻;其机制与阿片系统和炎症通路的交互调控有关。
- 神经保护应用拓展:在大鼠帕金森病模型(MPTP 诱导)中,侧脑室注射该肽段可显著提高黑质多巴胺能神经元的存活率,纹状体多巴胺水平提升 40%,运动功能缺损明显改善;其神经保护作用与激活 PI3K-Akt 抗凋亡通路、抑制氧化应激有关。
五、相关案例分析
- 镇痛活性案例:在大鼠热板镇痛实验中,腹腔注射大鼠 β- 内啡肽(剂量 1 mg/kg)后,大鼠的痛阈在 15 分钟内升高 60%,镇痛效果持续 6 小时;预先注射纳洛酮(剂量 2 mg/kg)可完全阻断其镇痛作用,证实镇痛作用依赖 MOR 激活。
- 食欲调控案例:在大鼠禁食 48 小时模型中,侧脑室注射该肽段(剂量 10 μg/kg)后,大鼠在 2 小时内的食物摄入量是对照组的 2.5 倍,且体重增加幅度显著高于对照组;检测下丘脑 NPY 的 mRNA 表达水平,发现其上调幅度达 3 倍,证实其通过促进 NPY 释放调控食欲。
- 神经保护案例:在大鼠脑缺血模型(大脑中动脉阻塞)中,缺血后 30 分钟静脉注射该肽段(剂量 2 mg/kg),可使脑梗死面积缩小 40%,神经细胞凋亡率降低 50%;治疗后 7 天,大鼠的神经功能缺损评分显著降低,运动能力明显恢复,证实其具有强效的缺血性脑保护作用。
更多推荐
 已为社区贡献27条内容
已为社区贡献27条内容









所有评论(0)