【医学影像 AI】基于CNN的 ROP 早期诊断与分级
本文提出了一种基于深度卷积神经网络(CNN)的早产儿视网膜病变(ROP)早期诊断与分级系统。该研究为ROP早期诊断提供了客观、自动化的解决方案,具有重要的临床应用价值。
【医学影像 AI】基于CNN的 ROP 早期诊断与分级
0. 论文简介
0.1 基本信息
2022 年 同济大学 Peng Li 等在 Medical Image Analysis 发表论文 “基于CNN的 ROP 早期诊断与分级(Early Diagnosis and Quantitative Analysis of Stages in Retinopathy of Prematurity Based on Deep Convolutional Neural Networks)”。
论文下载: tvst,
引用格式:
Li P, Liu J. Early Diagnosis and Quantitative Analysis of Stages in Retinopathy of Prematurity Based on Deep Convolutional Neural Networks. Transl Vis Sci Technol. 2022 May 2;11(5):17. doi: 10.1167/tvst.11.5.17. PMID: 35579887; PMCID: PMC9123509.
0.2 摘要
- 目的: 早产儿视网膜病变(ROP)是儿童失明的主要原因。及时准确地诊断ROP的早期阶段可以使眼科医生在失明仍可预防时推荐合适的治疗方法。本研究的目的是开发一个基于自动深度卷积神经网络的系统,该系统可以使用特征参数对ROP的I至III期进行诊断。
- 方法: 我们建立了三个数据集,包含18,827张早产儿的视网膜图像。这些视网膜图像来自中国嘉兴市妇幼保健医院的眼科部门。通过分割图像后,我们计算了感兴趣区域(ROI)。我们在训练数据集分割的ROI图像上训练了系统,在测试数据集上测试了分类器的性能,并在比较数据集上评估了系统提取的分界线或嵴状物的宽度以及ROI内血管增生的比例。
- 结果: 训练后的网络对I期ROP的诊断灵敏度为90.21%,特异性为97.67%;对II期ROP的诊断灵敏度为92.75%,特异性为98.74%;对III期ROP的诊断灵敏度为91.84%,特异性为99.29%。当系统诊断正常图像时,灵敏度和特异性分别达到了95.93%和96.41%。分界线或嵴状物的宽度(以像素为单位)正常、I期、II期和III期分别为15.22±1.06、26.35±1.36和30.75±1.55。ROI内的血管增生比例分别为1.40±0.29、1.54±0.26和1.81±0.33。所有参数在组间统计上均有所不同。当医生结合提取特征的定量参数与临床诊断时,κ分数显著提高。
- 结论: 我们的系统在对I至III期ROP的诊断中表现出很高的准确性,并使用提取特征的定量分析来辅助医生提供分类决策。
- 转化医学意义: 系统的高性能表明其在辅助诊断ROP早期阶段的应用潜力。
1. 引言
早产儿视网膜病变(ROP)是一种血管增殖性疾病,主要发生在体重较轻、妊娠期较短的早产儿中[1]。这种疾病是儿童失明的主要原因之一。随着早产儿的生存率提高,患有ROP的儿童数量也在增加[2]。1980年代,制定了国际ROP分类法[3]。2005年进行了修订[4],2021年发布了第三版[5]。根据该指南,ROP的诊断涉及三个维度:I至V期、I至III区以及预增生或增生疾病的存在[6]。
准确及时地通过临床视网膜检查或阅读视网膜图像诊断ROP非常重要。然而,由于分类指南仅提供定性的指示,这导致诊断结果主要依赖于眼科医生的主观决策[6]。此外,当不同专家在不同地区使用不同硬件时,诊断结果也会存在差异。所有这些都导致ROP的诊断结果不一致。
为了解决这个问题,许多专家开发了半自动定量分析工具,以更客观地诊断ROP[7]。他们的结果包括ROP Tool[7]、主连通森林算法[8]、计算机辅助视网膜图像分析[9]等。然而,这些方法并非完全自动化,仍需人工确定特征和切点[10]。总体而言,输出结果不太能与临床诊断相关联,无法广泛使用[10]。
深度卷积神经网络(DCNN)[11]在许多医学图像应用中显示出巨大优势[12-15]。DCNN提供了一个完全自动化、端到端的解决方案,不需要手动输入,这是其一大优势[11]。增生疾病,许多专家都在研究,是确定ROP是否需要治疗的重要特征[16]。2016年,Worrall等人[16]开始使用DCNN来诊断早产儿的增生疾病。Brown等人[17]研究了一种完全自动化的系统,能够以很高的准确性将视网膜图像分类为正常、预增生和增生[17]。
在另一方向上,对ROP早期阶段的诊断也进行了研究。这不仅是因为早期阶段的诊断依赖于主观解释[6],而且第一阶段和第三阶段之间的诊断也非常关键[4],允许在失明仍可预防时推荐适当的治疗。相比之下,第四阶段和第五阶段的患者已有不可逆转的视网膜损伤[19]。
2018年,Hu等人[18]将DCNN应用于I至III期ROP的诊断。Mulay等人[19]和Ding等人[20]基于DCNN,使用分割图像对ROP的不同阶段进行诊断。这不仅是因为I至III期和正常的视网膜通过边界线或嵴的存在、大小和形状、以及血管增生更为细致地分类[20],而且这些特征适合作通过DCNN分割获得[20]。
虽然DCNN在医学图像领域显示出改进的性能[21],但它们也有局限性,即依靠的特征不透明或不可解释[22]。这种局限性对DCNN的采用构成了巨大挑战,因为医疗问责是重要的,可能导致严重的法律责任。理想的系统不仅应提供客观结果,还应解释这些结果背后的原因[22]。许多专家尝试通过结合DCNN和传统特征提取来使DCNN更具可解释性[23,24]。Ma等人[23]和Yildiz等人[24]在增生疾病的诊断方面开展了类似工作。
在本研究中,我们开发了一个基于自动化DCNN的系统。使用分割图像,我们训练了一个分类器,将图像分类为四种类别:正常、I期ROP、II期ROP和III期ROP。通过评估我们系统提取的特征参数,我们展示了不同类别之间的显著差异。此外,我们展示了这些参数在提高人工诊断一致性方面的作用。据我们所知,这是首次尝试对分割特征进行定量分析以诊断ROP早期阶段[25]。
2. 方法
本研究得到了中国嘉兴市妇幼保健医院伦理审查委员会的批准,并遵循了《赫尔辛基宣言》的原则。
2.1 数据
所有早产儿的图像均于2018年1月至2020年12月在嘉兴市妇幼保健医院的眼科部通过使用Retcam3(Natsu Medical, Inc., 帕洛阿尔托, 加利福尼亚州, 美国)的成像系统收集。这些图像来自五个标准视野(后部、鼻侧、颞侧、上方、下方),每个视野图像大小为1600×1200像素。
在丢弃低质量图像后,我们选择了来自37周以下妊娠和2000克以下体重的早产儿的18,827张视网膜图像。我们邀请了几位专家(至少3位)根据以下标准通过共识选择删除低质量图像:
- 由于存在异物、对焦不良、模糊或极端光线条件等原因,周边视网膜区域少于25%无法观察。
- 血管图像的清晰度不足作为参考标准。
我们构建了三个数据集:用于训练DCNN的训练数据集,用于测试网络性能的测试数据集,以及用于比较DCNN预测与人工诊断的比较数据集。我们在训练和测试数据集中为每张图像指定了参考诊断标准(I期ROP, II期ROP, III期ROP, 或正常)。参考诊断标准由三位ROP专家达成的共识诊断确定,并与之前的临床诊断进行了比较。
表1 描述了三个数据集的特征,分别包括来自2260名、567名和73名不同妊娠周数和体重的早产儿的14,626张、3680张和521张视网膜图像。每只眼睛获取了不同标准视野的多张图像,这大大增加了图像的数量。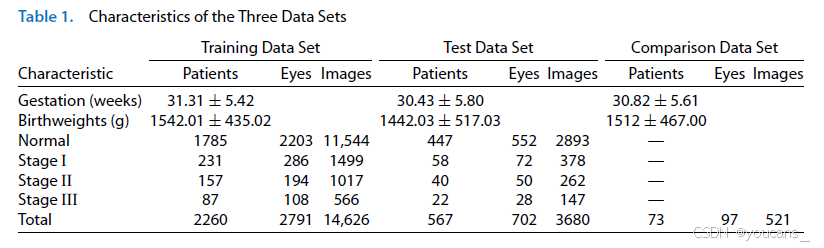
为了训练血管分割网络,我们从训练数据集中选择了1825张(204名婴儿)视网膜图像,并按照1464张(162名婴儿)训练和361张(42名婴儿)测试的比例进行训练和测试。眼科医生使用专用标注软件中的画笔标注工具对视网膜血管进行标注。
为了训练分界线或嵴的分割网络,我们从训练数据集中选择了2738张(306名婴儿)视网膜图像,并按照2196张(243名婴儿)训练和542张(63名婴儿)测试的比例进行训练和测试。眼科医生使用专用标准软件绘制分界线或嵴的边界多边形,并标注多边形区域。
测试数据集包含3680张图像(567名婴儿),其中2893张为正常(447名婴儿),378张为I期ROP(58名婴儿),262张为II期ROP(40名婴儿),147张为III期ROP(22名婴儿)。视网膜筛查的时间、随访的时间间隔以及阈值ROP和亚阈值ROP的治疗时间均严格按照指南执行。一旦婴儿出现阈值ROP或亚阈值ROP,即进行治疗。因此,本研究中不存在IV期和V期ROP的病例。
比较数据集中的所有图像均来源于73名婴儿。我们提取了特征参数以分析组间差异以及特征与阶段之间的相关性。我们邀请了两名具有不同经验的眼科医生分别对图像进行诊断,以研究基于定量分析的系统在ROP阶段临床诊断中的重要意义。
2.2 网络架构
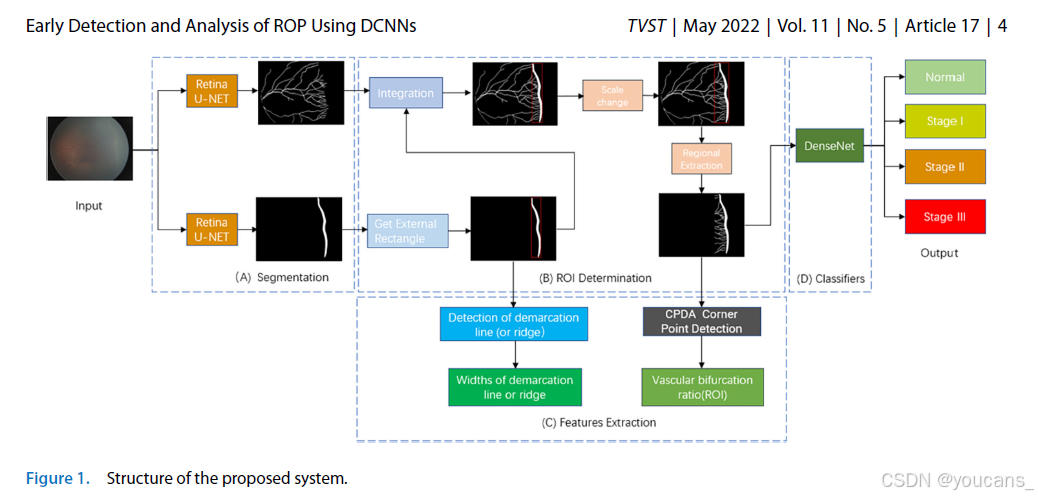
我们的系统结构如图1所示。图像输入通过两个深度学习网络进行分割(图1A)。然后,我们计算了感兴趣区域(ROI,图1B),并提取了特征参数(图1C)。我们使用分割后的ROI图像训练分类器(图1D),以诊断正常和I至III期ROP。
2.2 分割
如图1所示,系统输入的视网膜图像首先通过两个深度学习网络进行分割。一个网络负责分割视网膜血管,另一个网络负责分割分界线或嵴。
我们使用了两个开源的Retina U-Nets26作为分割网络。在训练过程中,我们修改了不同层之间的卷积核数量,应用了随机梯度优化器,并设置了动量为0.9,学习率为0.001,批量大小为32,梯度裁剪为5.0。Retina U-Nets从高斯分布N(0, 0.01)初始化。在整个分割过程中,图像的尺寸(以像素计)始终保持原大小(1600 × 1200)。我们使用整个图像而不是切片或裁剪它们。
2.2 ROI 确定
在使用Otsu算法二值化分割后的图像后,我们使用Canny边缘检测算法28检测分界线或嵴的轮廓。随后,我们使用Sklansky算法29查找凸包,再通过旋转卡尺算法30获得最小外接矩形。最后,我们使用非极大值抑制去除冗余矩形。
我们使用来自OpenCV4.5.2(开源计算机视觉库)的cv2逻辑或函数将分割后的血管与分割后的分界线或嵴进行整合。由于它们的尺寸均为1600 × 1200,我们无需调整图像大小。我们使用最小外接矩形的长度和宽度1.5倍作为参数绘制新矩形。为了研究分界线或嵴附近的血管增生,我们在血管方向上偏移该矩形。最终,我们得到该矩形区域(ROI)。
2.3 特征提取
我们对二值化的分割图像进行欧氏距离变换。通过计算最近轮廓像素的距离,我们获得了分割后的分界线或嵴的宽度。我们还使用了Zhan-Suen快速并行精炼算法31从分割后的血管中提取中心线。通过Chord-to-Point Distance Accumulation(CPDA)检测方法进行角点检测后,我们获得了所有候选节点。我们基于从候选点区分的分叉点使用自适应矩形窗口计算分叉比。我们仅分析了ROI内的分叉点,并将所有获得的参数取平均。
2.4 分类器
我们使用Dense Net33对图像进行分类,分为四个类别:正常、I期ROP、II期ROP和III期ROP。Dense Net是一种优秀的分类网络,具有缓解梯度消失问题、增强特征传递、鼓励特征重用以及大大减少参数数量的优点。我们将最终层的输出设置为4,批量大小设置为20。我们还利用ImageNet34数据集的迁移学习初始化模型权重。通过水平翻转、垂直翻转以及在六个不同的角度旋转它们,我们应用数据增强。
2.5 统计分析
我们使用接收者操作特征曲线下的面积(AUC)分数来衡量分类器在训练过程中的性能。为了防止过拟合和欠拟合,我们将训练数据集分为五部分,随机选择四部分进行训练,其余部分用于测试。交叉验证重复五次(五折交叉验证),并使用Hanley和McNeil的公式计算95%的置信区间。我们使用Scikit-Learn库工具(法国内科研究计算机科学与自动化研究所,罗恩格朗库尔,法国)计算AUC分数。
基于AUC分数,我们选择了最佳配置并进行了性能测试。为了衡量分类器的性能,我们计算了测试数据集结果的敏感性和特异性。
指南4 告诉我们,I至III期ROP和正常视网膜的分类依赖于分界线或嵴的存在、大小和形状以及血管增生。因此,我们的系统评估了分界线或嵴的宽度以及ROI内的血管增生比例。
我们对比较数据集图像提取的特征参数进行了单因素方差分析(ANOVA)以获得I至III期之间的差异。对于ANOVA,我们进行了χ2检验,并使用S-N-K和Duncan假设相等的方差。
由于阶段的时间序列性质,我们对提取的特征参数进行了有序逻辑回归。我们进行了平行线测试,确保自回归系数在所有独立变量中始终保持不变。我们还设置了95%的置信区间、最大逐步二次得分5以及最大迭代次数100。最后,我们选择了III期为参考特征参数。
我们还邀请了两名具有不同经验的眼科医生对比较数据集进行手动诊断。我们使用DCNN预测结果和手动诊断结果计算κ值,以探讨系统在改善临床诊断结果一致性方面的角色。
2.6 实验
所有网络均在TensorFlow1.10(NVIDIA, Santa Clara, CA, USA)中实现,并在配备NVIDIA GeForce TITAN XP GPU的计算机上进行评估。所有统计分析均使用SPSS Statistics 26.0(IBM, Armonk, NY, USA)进行。
3. 结果
3.1 自动分割血管和分界线或嵴
图2展示了四个类别中血管和分界线或嵴的分割结果。对于血管,敏感性为0.82,特异性为0.98。据我们所知,目前尚无使用DCNN对I至III期ROP进行定量分析的研究。然而,之前使用DCNN方法分割视网膜血管的研究取得的敏感性和特异性分别为0.7至0.9和0.8至0.9 [23]。 Mao等人使用修改后的U-Net分割早产儿视网膜图像中的血管,获得了敏感性为0.72和特异性为0.99。在本工作中,分界线或嵴的分割敏感性达到了0.93,特异性为0.99。
图2展示了原始图像及其分割图像。第一行是输入的视网膜图像,中间行显示了分割后的血管,最后一行显示了分割后的分界线或嵴。从左至右,图像按不同阶段(正常、I期、II期和III期)排序。正常图像中未检测到分界线或嵴,因此第一列的分割图像完全为黑色(背景)。
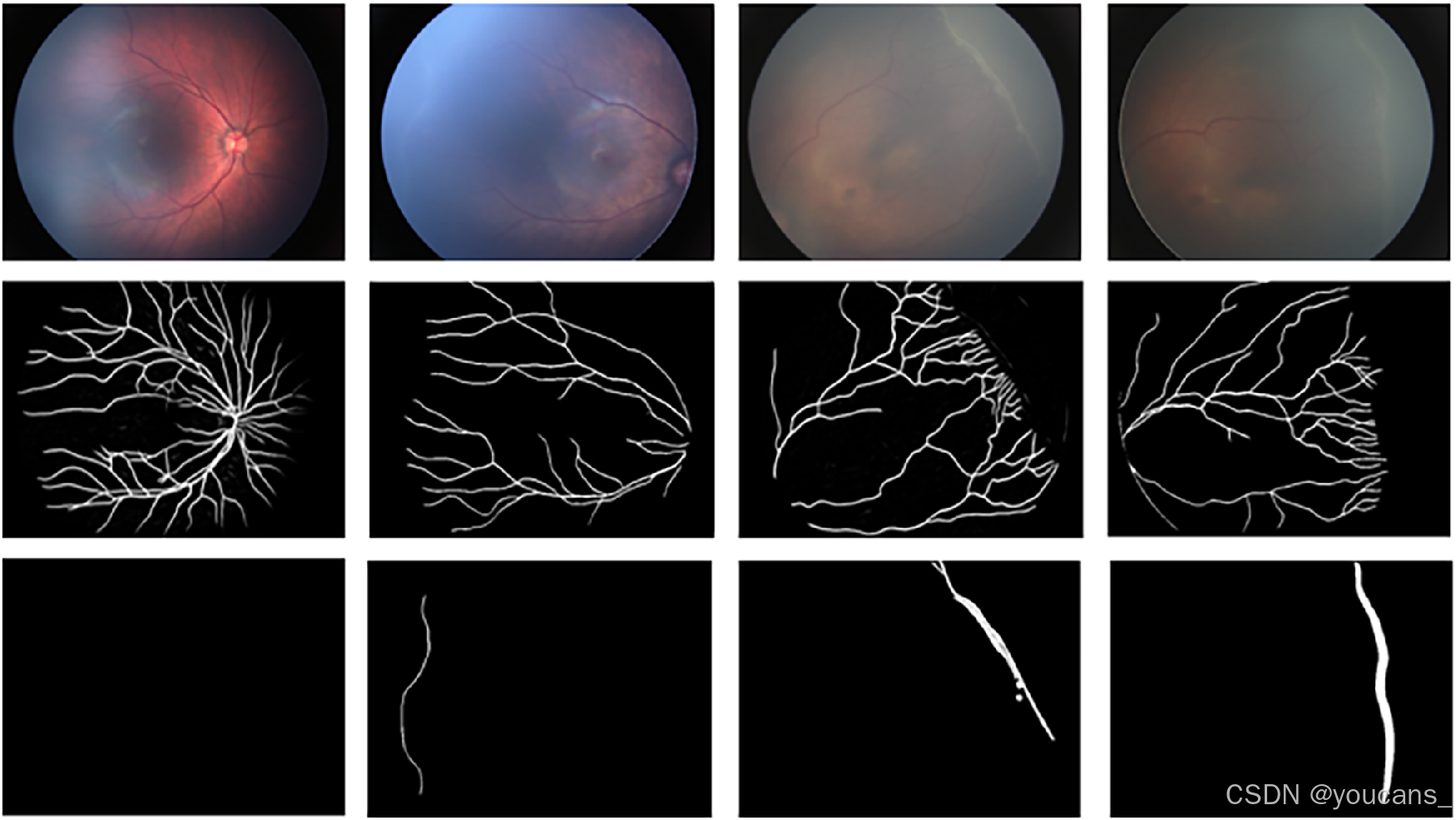
图2. 原始图像与分割图像。
3.2 感兴趣区域(ROI)的确定
如图3所示,第一行为原始视网膜图像,第三行呈现的是带有最小外接矩形(红色矩形)的分界线或脊状结构分割图像,第四行则是整合了红色矩形(ROI)的完整分割图像。最后一行图像除ROI区域外均为黑色背景,这些图像将作为分类器的输入数据。我们同时从分割图像中提取特征参数进行统计分析,相关数据详见特征参数提取的统计章节。
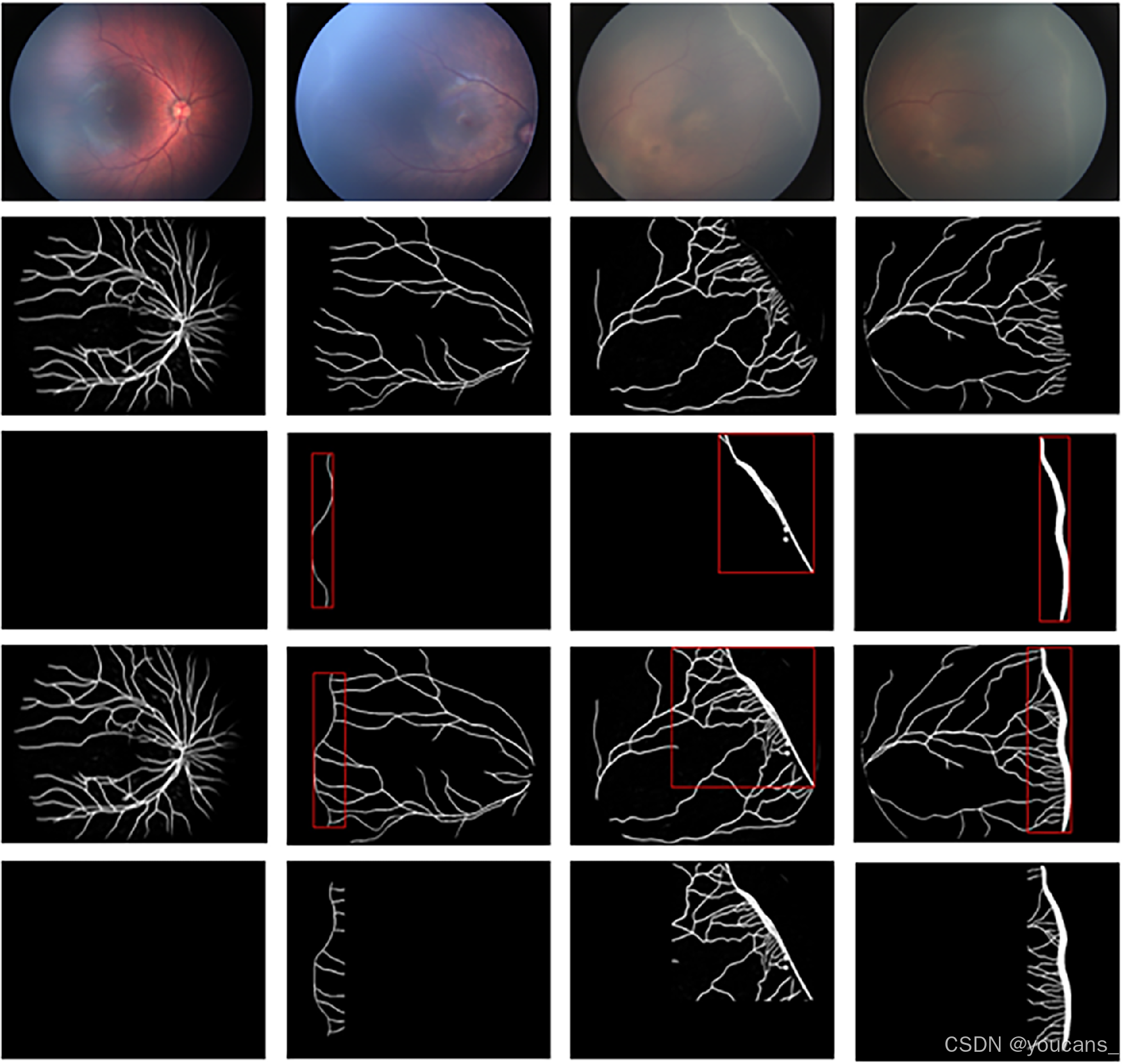
图3. ROI确定过程中的各阶段图像。
3.3 分类器的训练与性能表现
我们采用卷积神经网络分类器(DenseNet)对I至III期ROP进行诊断,分类器在训练数据集上的训练结果如图4所示。该分类器取得的平均AUC评分分别为:正常眼0.9612(图4A)、I期ROP 0.9252(图4B)、II期ROP 0.9868(图4C)、III期ROP 0.9875(图4D)。根据五折交叉验证结果,我们选择表现最佳的网络配置(蓝色曲线),其对所有分期诊断的平均AUC评分达到0.9663。
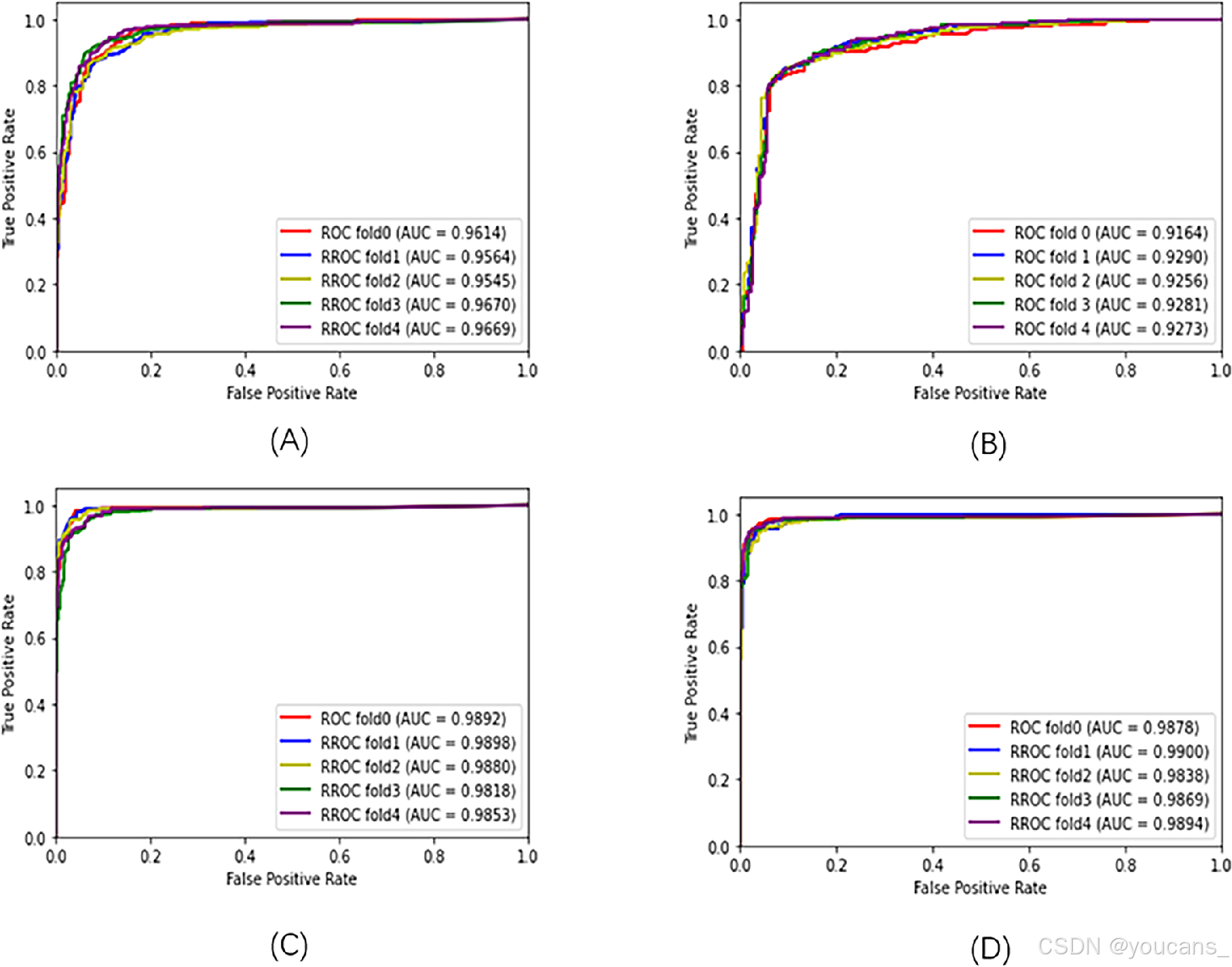
图4. 分类器在训练数据集上进行的五折交叉验证。
我们在测试数据集上评估了分类器的性能,结果如表2所示。如表2数据显示,该网络在3680张图像中正确诊断了3508张(准确率95.33%)。具体而言:对于I期ROP诊断的敏感度为90.21%、特异度97.67%;II期ROP诊断的敏感度为92.75%、特异度98.74%;III期ROP诊断的敏感度为91.84%、特异度99.29%。在正常图像诊断方面,系统展现的敏感度与特异度分别达到95.93%和96.41%。
测试数据集上的DCNN预测与参考标准对比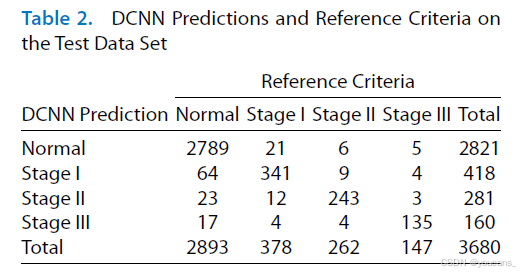
3.4 提取特征的统计学分析
基于对比数据集的分割视网膜图像,我们评估了分界线/脊的宽度以及感兴趣区域内血管增生比例的特征值。对特征数据进行了单因素方差分析(one-way ANOVA),结果如 表3所示。
特征参数的单因素方差分析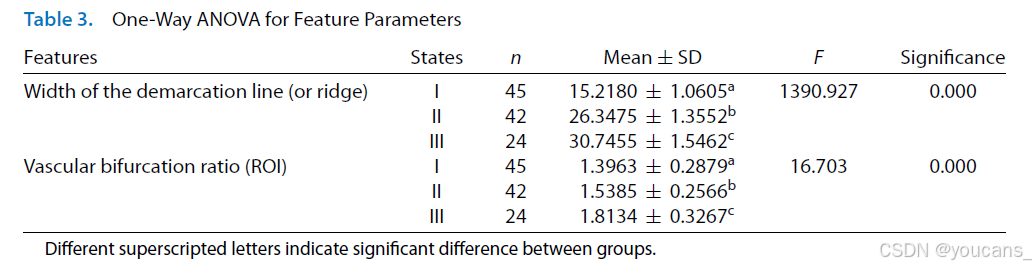
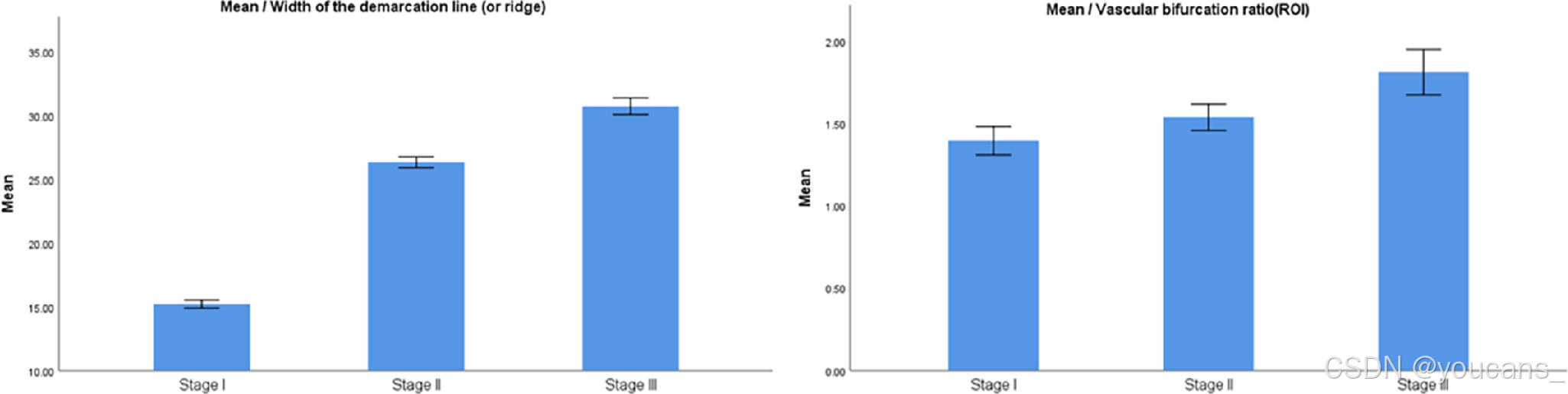
单因素方差分析结果如表3所示:I期、II期和III期ROP的分界线/脊宽度(像素)分别为15.22±1.06、26.35±1.36和30.75±1.55,而感兴趣区内血管增生比例分别为1.40±0.29、1.54±0.26和1.81±0.33。各组间所有参数均具有统计学差异(P < 0.001,95%置信区间)。需说明的是,分割后的正常视网膜图像输入均为黑色背景,因此未计入表3统计。
分割特征的平均参数值如图5所示。所有参数从I期至III期均呈现显著增长趋势,并在III期达到峰值。
我们还对特征参数进行了有序逻辑回归分析。平行性检验满足要求(P > 0.05),模型拟合χ²值为429.112(P < 0.001),Cox-Snell值为0.882,表明该回归模型可解释高达88.20%的参数变异。
以III期ROP的特征参数为参照,我们将模型划分为两个二元逻辑子模型(结果见表4)。研究发现I-III期ROP的分类与分界线/脊宽度及ROI内血管增生比例显著相关(P < 0.001,95%置信区间):分界线宽度较大的图像被归类为II期或III期的几率提高10.89倍;而血管分叉比例较大的图像被归类为II期或III期的几率高达45.02倍。
针对特征参数的有序逻辑回归分析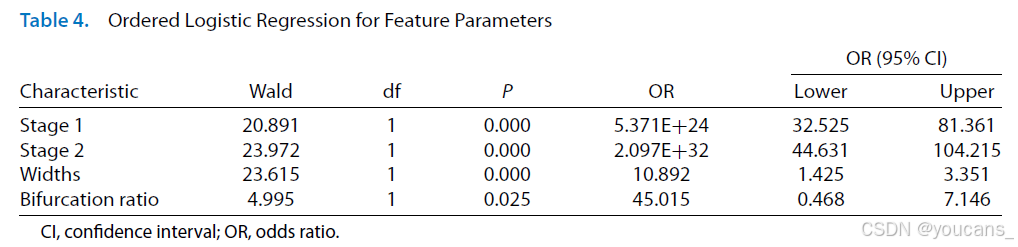
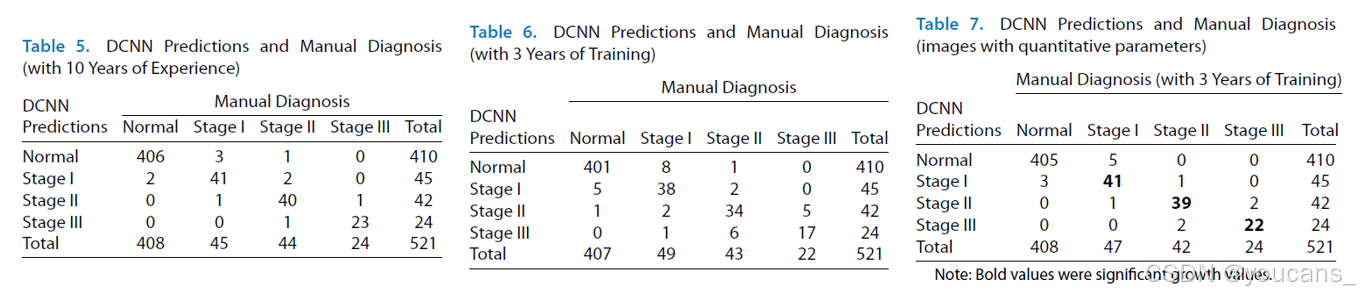
我们邀请两位眼科医师(一位具有10年以上临床经验,另一位仅接受过3年规范化培训)对对照数据集的视网膜图像进行诊断。
如表5所示,我们计算了DCNN预测与10年经验眼科医师诊断结果的一致性κ值(κ=0.9425),显示近乎完美的一致性。针对仅有3年培训经验的眼科医师,其使用原始视网膜图像诊断时的κ值为0.8385(表6),而采用特征参数图像诊断时κ值提升至0.9268(表7)。研究发现眼科医师可将定量分割特征作为临床诊断依据,通过结合人工诊断与定量参数,显著提高了早期ROP诊断结果的一致性。
4. 讨论
本研究开发了一种基于DCNN的自动诊断系统。通过使用ROI区域内的分割图像进行系统训练,该系统可基于提取参数完成I-III期ROP诊断,并实现了对这些参数的定量分析。与Ding等[20]采用的Mask R-CNN架构不同,我们结合了两个Retina U-Net和一个Dense Net。Retina U-Net整合了单阶段检测器Retina Net[37]与U-Net[38]结构,能更好地保留图像位置信息。通过计算ROI提取特征的方法,我们实现了数据压缩。整个流程中始终维持原始图像尺寸,而非如Ding等[20]将图像调整为299×299像素并进行随机切片后训练。Kim等[39]研究表明,基于完整图像的视网膜外观评估相比四分象限评估能提供更准确可靠的DCNN分类结果。
采用Dense Net作为分类器,我们在测试数据集四类分类中实现了97.98%的整体准确率(κ=0.9425)。Ding等[20]在类似工作中获得67%的准确率。当然,由于数据集差异,性能指标不宜直接比较。
更重要的是,本研究不仅提供基于DCNN的自动分类器,还对提取的特征参数进行了定量分析。ROI内分界线/嵴宽度参数与血管增殖比率的统计分析显示,所有定量参数在各组间均呈现显著递增趋势,这有助于增强DCNN预测的可解释性。
参数的有序逻辑回归结果显示,ROI内血管分叉比率具有更大的比值比(45.015 vs. 10.892),说明该参数在II-III期诊断中贡献更大。图5中比率参数的定量分析显示I期与II期间差异较小,表明系统在I期诊断中更依赖宽度参数,这解释了为何I期灵敏度仅达90.21%。最终逻辑模型仅能解释88.2%的参数变异,表明DCNN学习了比现有两个特征更丰富的特征。未来对DCNN所学习特征的解析与可视化将极具研究价值。
在对照数据集测试中,医师将提取特征的定量参数整合至临床诊断后,κ值从0.8385提升至0.9268,提示本研究可能有助于缓解医院眼科医师数量不足的现状[40]。
4.1 局限
输入图像是本系统的潜在限制:1) 仅采用嘉兴市妇幼保健院Retcam3采集的早产儿高质量视网膜图像,但Retcam3价格昂贵,多数医院使用PanoCam(苏州维视艾康特)等替代设备导致图像差异;2) 新生儿筛查中发现许多体重较大足月儿罹患ROP,仅从早产儿图像提取特征可能不足;3) 严格筛选高质量图像可能丢失次优图像中的特征信息。
4.2 未来工作
计划联合不同地区医院获取多设备采集的早产儿视网膜图像,并扩展至新生儿筛查图像进行ROP特征提取。将研究更严格的定量图像筛选标准,开发预处理模块实现自动化客观筛选,同时探索DCNN所学习特征的解析与可视化方法。
5. 结论
本研究所开发的系统能够为I至III期ROP提供准确诊断。眼科医师可将DCNN决策与特征定量分析相结合,以此辅助制定最优诊断判断。
6. 参考文献
1. Flynn JT, Bancalari E, Bachynski BN, et al. Retinopathy of prematurity: diagnosis, severity, and natural history. Ophthalmology. 1987;94(6): 620–629.
2. Gilbert C, Field A, Gordillo L, et al. Characteristics of infants with severe retinopathy of prematurity in countries with low, moderate, and high levels of development: implications for screening programs. Pediatrics. 2005;115(5):E518–E525.
3. International Committee for the Classification of Retinopathy of Prematurity. An international classification of retinopathy of prematurity. Arch Ophthalmol. 1984;102:1130–1134.
4. International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited. Arch Ophthalmol. 2005;123(7):991–999.
5. Chiang MF, Quinn GE, Fielder AR, et al. International Classification of Retinopathy of Prematurity, Third Edition. Ophthalmology. 2021;128(10):e51–e68.
6. Campbell JP, Aater-Cansizoglu E, Bolon-Canedo V, et al. Expert diagnosis of plus disease in retinopathy of prematurity from computer-based image analysis. JAMA Ophthalmol. 2016;134(6):651–657.
7. Wallace DK, Zhao Z, Freedman SF. A pilot study using “ROPtool” to quantify plus disease in retinopathy of prematurity. J AAPOS. 2007;11(4):381–387.
8. Bas E, Ataer-Cansizoglu E, Erdogmus D, Kalpathy-Cramer J. Retinal vasculature segmentation using principal spanning forests. 9th IEEE International Symposium on Biomedical Imaging (ISBI) - From Nano to Macro, Barcelona, Spain. IEEE; 2012:1792–1795.
9. Wittenbery LA, Jonsson NJ, Chan RVP, Chiang MF. Computer-based image analysis for plus disease diagnosis in retinopathy of prematurity. J Pediatr Ophthalmol Strabismus. 2011;49(1):11–19.
10. Wilson CM, Wong KR, Ng J, Cocker KD, ELLs AL, Fielder AR. Digital image analysis in retinopathy of prematurity: a comparison of vessel selection methods. J AAPOS. 2012;16(3):223–228.
11. Lecun Y, Bengio Y, Hinton G. Deep learning. Nature. 2015;521(7553):436.
12. Ertosun MG, Rubin DL. Automated grading of gliomas using deep learning in digital pathology images: a modular approach with ensemble of convolutional neural networks. AMIA Annu Symp Proc. 2015;2015:1899.
13. Sim Y, Chung MJ, Kotter E, et al. Deep convolutional neural network-based software improves radiologist detection of malignant lung nodules on chest radiographs. Radiology. 2020;294(1):199–209.
14. Fujisawa Y, Otomo Y, Ogata Y, et al. Deep learning-based, computer-aided classifier developed with a small dataset of clinical images surpasses board-certified dermatologists in skin tumor diagnosis. Br J Dermatol. 2019;180(2):373–381.
15. Xiao H, MR-based synthetic CT generation using a deep convolutional neural network method. Med Phys. 2017;44(4):1408–1419.
16. Worrall DE, Wilson CM, Brostow GJ. Automated retinopathy of prematurity case detection with convolutional neural networks. 2nd International Workshop on Deep Learning in Medical Image Analysis (DLMIA). Athens, Greece:Springer, Cham; 2016:68–76.
17. Brown JM, Campbell JP, Beers A, et al. Automated diagnosis of plus disease in retinopathy of prematurity using deep convolutional neural networks. JAMA Ophthalmol. 2018;136(7):803–810.
18. Hu J, Chen Y, Zhong J, Ju R, Yi Z. Automated analysis for retinopathy of prematurity by deep neural networks. IEEE Trans Med Imaging. 2018;38(1):269–279.
19. Mulay S, Ram K, Sivaprakasam M, Vinekar A. Early detection of retinopathy of prematurity stage using deep learning approach. Medical Imaging 2019: Computer-Aided Diagnosis.. San Diego, CA: SPIE; 019;10950:758–764.
20. Ding A, Chen Q, Cao Y, Liu BY, et al. Retinopathy of prematurity stage diagnosis using object segmentation and convolutional neural networks. International Joint Conference on Neural Networks (IJCNN). Glasgow, UK: IEEE; 2020:1–6.
21. Litjens G, Kooi T, Bejnordi BE, et al. A survey on deep learning in medical image analysis. Med Image Anal. 2017;42:60–88.
22. Ting DSW, Peng L, Varadarajan AV, et al. Deep learning in ophthalmology: the technical and clinical considerations. Prog Retin Eye Res. 2019;72:100759.
23. Mao J, Luo Y, Liu L, et al. Automated diagnosis and quantitative analysis of plus disease in retinopathy of prematurity based on deep convolutional neural networks. Acta Ophthalmol. 2020;98(3):E339–E345.
24. Yildiz VM, Tian P, Yildiz I, et al. Plus disease in retinopathy of prematurity: convolutional neural network performance using a combined neural network and feature extraction approach. Transl Vis Sci Technol. 2020;9(2):10–10.
25. Yuen V, Ran A, Shi J, et al. Deep-learning-based pre-diagnosis assessment module for retinal photographs: a multicenter study. Transl Vis Sci Technol. 2021;10(11):16.
26. Jaeger PF, Kohl SAA, Bickelhaupt S, et al. Retina U-Net: embarrassingly simple exploitation of segmentation supervision for medical object detection. PMLR. 2020:171–183.
27. Otsu N. A threshold selection method from graylevel histograms. IEEE Trans Syst Man Cybernet. 2007;9(1):62–66.
28. Canny J. A computational approach to edge detection. IEEE Trans Pattern Anal Machine Intell. 1986;PAMI-8(6):679–698.
29. Sklansky J, Nahin PJ. A parallel mechanism for describing silhouettes. IEEE Transactions on Computers. 1972;100(11):1233–1239.
30. Robert JM, Toussaint G. Computational geometry and facility location. Proc. International Conference on Operations Research and Management Science. Athens, Greece: Wiley-Blackwell; 1990.
31. Zhang TY, Suen CY. A fast parallel algorithm for thinning digital patterns. Comm ACM. 1984;27(3):236–239.
32. Awrangjeb M, Lu G. Robust image corner detection based on the chord-to-point distance accumulation technique. IEEE Trans Multimedia. 2008;10(6):1059–1072.
33. Huang G, Liu Z, Laurens VDM, Weinberger KQ. Densely connected convolutional networks. Proceedings of the IEEE Conference on Computer Vision and Pattern Recognition (CVPR). Honolulu, HI, USA: IEEE; 2017:4700–4708.
34. Russakovsky O, Deng J, Su H, et al. ImageNet large scale visual recognition challenge. Int J Comput Vis. 2015;115(3):211–252.
35. Hanley JA, McNeil BJ. The meaning and use of the area under a receiver operating characteristic (ROC) curve. Radiology. 1982;143(1):29.
36. Wang S, Yin Y, Cao G, Wei BZ, Zheng YJ, Yang GP. Hierarchical retinal blood vessel segmentation based on feature and ensemble learning. Neurocomputing. 2015;149:708–717.
37. Lin TY, Goyal P, Girshick R, He KM, Dollar P. Focal loss for dense object detection. Proceedings of the IEEE International Conference on Computer Vision. 2017:2980–2988.
38. Ronneberger O, Fischer P, Brox T. U-Net: convolutional networks for biomedical image segmentation. Med Image Comput Comput Assist Intervent. 2015;9351:234–241.
39. Kim SJ, Campbell JP, Kalpathy-Cramer J, et al. Accuracy and reliability of eye-based vs quadrantbased diagnosis of plus disease in retinopathy of prematurity. JAMA Ophthalmol. 2018;136(6):648–655.
40. Gilbert C. Retinopathy of prematurity: a global perspective of the epidemics, population of babies at risk and implications for control. Early Hum Dev. 2008;84(2):77–82.
版权说明:
本文由 youcans@xidian 对论文 Early Diagnosis and Quantitative Analysis of Stages in Retinopathy of Prematurity Based on Deep Convolutional Neural Networks
进行摘编和翻译。该论文版权属于原文期刊和作者,本译文只供研究学习使用。
youcans@xidian 作品,转载必须标注原文链接:
【医学影像 AI】基于CNN的 ROP 早期诊断与分级(https://youcans.blog.csdn.net/article/details/151322986)
Crated:2025-09
更多推荐
 已为社区贡献199条内容
已为社区贡献199条内容







所有评论(0)