【放射学前沿】脑眼联动:帕金森病多模态成像的 “黑质 - 视网膜” 双窗口突破
黑质多模态 MRI 与视网膜 OCT 的结合,打破了 PD 诊断依赖 “症状出现” 的被动局面,实现了从 “晚期诊断” 向 “早期预警”、从 “单一脑成像” 向 “脑眼联动” 的转变。随着技术标准化与 AI 辅助诊断的发展,这一 “双窗口” 策略有望成为 PD 临床筛查、疗效监测的常规工具,为神经保护治疗赢得宝贵时间。未来,我们需要更多跨学科合作(放射科、神经科、眼科),推动成像标志物从 “科研”
【放射学前沿】脑眼联动:帕金森病多模态成像的 “黑质 - 视网膜” 双窗口突破
引言:帕金森病诊断的 “时间困境” 与成像曙光
帕金森病(PD)作为第二大神经退行性疾病,其核心挑战在于前驱期漫长而诊断滞后—— 当患者出现运动症状(静止性震颤、运动迟缓等)时,黑质致密部(SNc)的多巴胺能神经元已丢失超 50%。此时,神经保护治疗的窗口期已大幅缩窄。因此,寻找能早期识别 PD、监测进展的在体影像学 biomarkers,成为推动 PD 诊疗突破的关键。
传统核医学技术(PET/SPECT)虽能检测纹状体多巴胺能损伤,但存在分辨率低、辐射暴露、设备可及性差等局限。近年来,黑质多模态 MRI与视网膜光学相干断层扫描(OCT) 的兴起,为 PD 诊断提供了 “脑 - 眼” 双窗口:黑质 MRI 直接可视化多巴胺能神经元退变,视网膜 OCT 则通过 “眼脑同源” 特性间接反映中枢病理。本文将系统梳理这两大技术体系的原理、临床证据与应用前景,解读 PD 成像诊断的新范式。
一、PD 病理核心与诊断现状:为何需要新的成像标志物?
1. PD 的病理本质与临床诊断瓶颈
PD 的核心病理特征包括:① 黑质致密部多巴胺能神经元选择性丢失(尤其腹外侧部);② 路易小体 / 路易神经突形成(主要成分为 α- 突触核蛋白聚集)。此外,PD 并非局限于脑的疾病 —— 病理可累及肠神经系统、自主神经节、嗅觉 bulb 及视网膜,这为 “眼窗” 监测提供了病理基础。
当前 PD 诊断主要依赖临床症状(MDS-PD 标准):需满足 “运动迟缓 + 静止性震颤 / 肌强直”,并排除绝对排除标准、具备支持标准。核医学技术(如 ¹²³I-MIBG 心肌显像、¹⁸F-DOPA PET)被纳入诊断辅助,但存在明显不足:
- PET/SPECT 局限性:无法区分 PD 与 atypical 帕金森综合征(如 MSA、PSP); tracer 摄取受药物(如左旋多巴)干扰;设备昂贵且辐射暴露限制重复扫描。
二、黑质多模态 MRI:直接捕捉多巴胺能神经元退变的 “利器”
黑质是 PD 病理的 “原发灶”,先进 MRI 技术通过量化微结构、铁含量、神经黑色素等参数,实现对黑质退变的早期检测。
1. 扩散加权成像(DWI/DTI):量化黑质微结构破坏
原理与核心指标
扩散 MRI 通过测量水分子扩散运动反映组织微结构。在 PD 中,黑质神经元丢失、胶质增生导致组织完整性破坏,水分子扩散特性改变。核心技术包括:
-
扩散张量成像(DTI):通过各向异性分数(FA)、平均扩散率(MD)评估纤维束完整性 ——PD 患者黑质后部 FA 降低、MD 升高,但结果存在异质性。
-
自由水成像(双张量模型):分离 “组织内水” 与 “自由水”(如细胞外间隙增多),量化自由水分数(FW)。这是目前更敏感的指标:
- 早期 PD 患者黑质后部 FW 升高,且 4 年随访中与纹状体 DAT 丢失、Hoehn-Yahr 分期进展正相关;
- 前驱期 PD(如特发性 REM 睡眠行为障碍 iRBD)患者已出现黑质 FW 升高,且与壳核 DAT 值负相关。
临床价值与局限
FW 成像可监测早期 PD 进展,且样本量需求与 DAT SPECT 相当,适合临床研究。但局限性在于:晚期 PD 患者 FW 升高可能从后部转向前部,且与临床症状的相关性仍需验证。
2. 铁敏感成像:可视化黑质铁沉积与黑质体丢失
原理与核心技术
黑质是脑内铁含量最高的区域之一,PD 患者黑质铁代谢紊乱 —— 神经元丢失导致铁释放增加,铁沉积进一步加重氧化应激与神经元损伤。核心技术包括:
-
** susceptibility 加权成像(SWI)**:通过 T2 * 信号降低反映铁沉积,PD 患者黑质铁含量与疾病严重度正相关;
-
定量磁化率成像(QSM):直接量化组织磁化率,精准定位 SNc 铁沉积,且能检测全脑铁分布(如皮质、纹状体铁沉积与认知障碍相关);
-
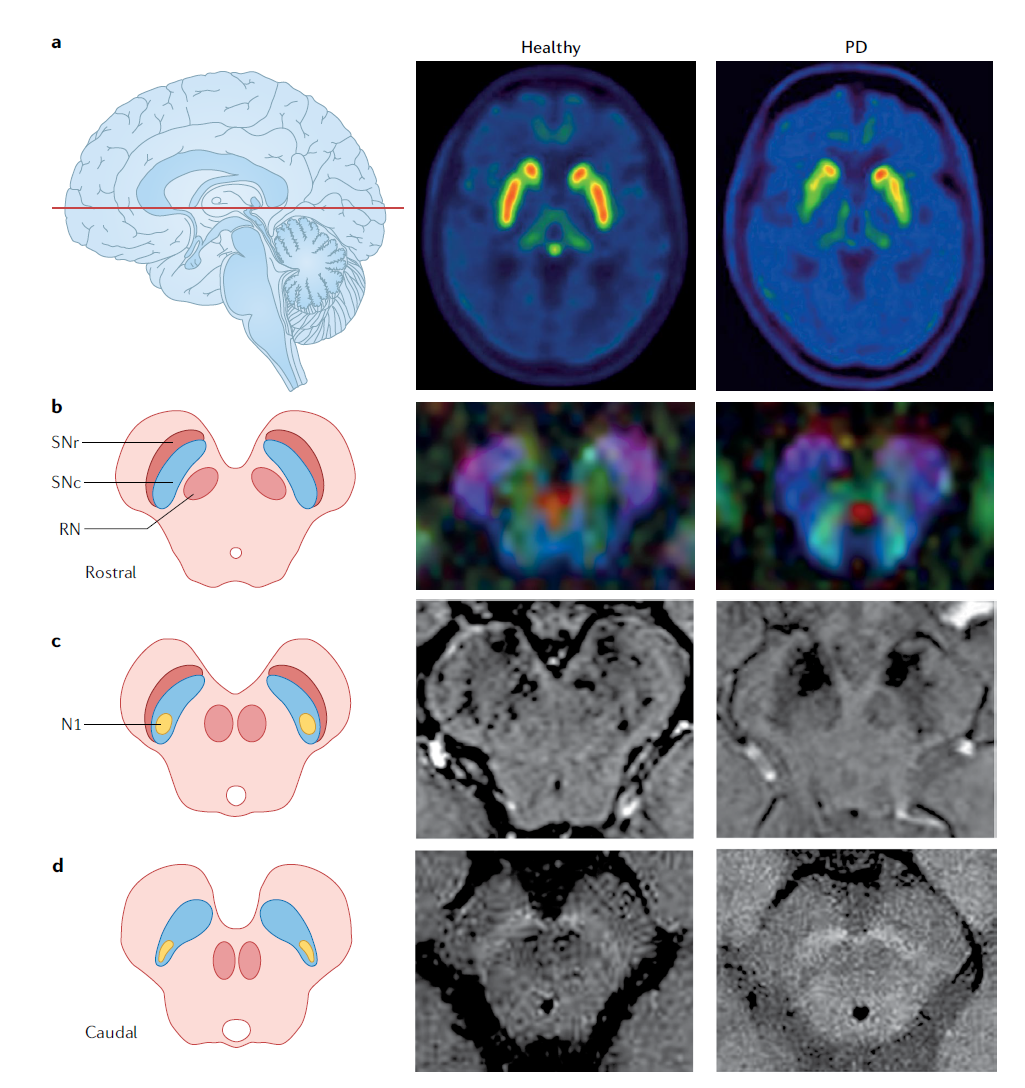
黑质体 1 区(N1)成像:N1 是黑质致密部最大的钙结合蛋白阴性多巴胺能细胞簇,正常在 SWI/QSM 上呈 “燕尾征”(背外侧高信号)。PD 患者因 N1 神经元丢失,“燕尾征” 消失 —— 这是 PD 早期诊断的关键标志:
- iRBD 患者 N1 信号丢失率(50%-78%)介于健康人(<20%)与 PD 患者(79%-90%)之间;
- 7T MRI 检测 N1 丢失的敏感性达 87%,显著优于 3T。
挑战与优化
N1 成像的主要问题是主观性强(依赖扫描协议与阅片者)。优化策略包括:① 结合 QSM 提升铁定量准确性;② 扫描平面垂直于 N1 轴,减少伪影;③ 建立标准化量化方法(如信号强度比值)。
3. 神经黑色素敏感成像:直接评估多巴胺能神经元储备
原理与 PD 中的表现
神经黑色素是多巴胺代谢产物,主要存在于 SNc 和蓝斑核的多巴胺能 / 去甲肾上腺素能神经元内,具有顺磁性,可增强 T1 信号。PD 患者因神经元丢失,神经黑色素含量降低,表现为:
- 黑质神经黑色素体积减少(尤其后部),与疾病 duration 正相关;
- 蓝斑核神经黑色素丢失:与 iRBD、PD 的 REM 睡眠行为障碍(RBD)相关,敏感性 / 特异性超 80%,可能是比黑质退变更早的病理事件。
临床价值
神经黑色素成像的优势在于:① 可指导其他 MRI 技术的 ROI 定位(如 DTI 以神经黑色素高信号区为 ROI,诊断准确性显著提升);② 纵向研究显示,神经黑色素丢失早于临床诊断约 5.3 年,可用于前驱期筛查。
4. 黑质多模态 MRI 的整合:1+1>2 的诊断效能
单一 MRI 技术难以全面捕捉 PD 异质性病理,多模态联合可显著提升诊断价值:
- 案例:一项纳入 40 例早期 PD 的研究显示,神经黑色素体积(AUC 0.960)联合 N1 信号(AUC 0.891)或铁含量(AUC 0.788)后,诊断 AUC 提升至 > 0.960;
- 机器学习辅助:自动化帕金森病成像鉴别(AID-P)系统整合 17 个皮层下区域的 FW 和 DTI 参数,可区分 PD 与 atypical 综合征,且适用于多中心数据。
三、视网膜 OCT:PD 的 “眼窗”—— 从病理关联到临床应用
视网膜与脑均来源于神经外胚层,且含多巴胺能神经元,PD 的视网膜病理与脑病理高度相关。OCT 作为无创、高分辨率成像技术,已成为 PD 视网膜监测的首选工具。
1. PD 的视网膜病理基础
PD 患者视网膜存在明确病理改变:
- 多巴胺能神经元丢失:视网膜多巴胺能无长突细胞位于内网状层与内核层交界处,PD 患者其密度降低(尤其旁中心凹区),导致视网膜细胞间耦合异常;
- α- 突触核蛋白聚集:视网膜神经节细胞(RGC)内出现磷酸化 α- 突触核蛋白(pSer129),与脑内路易小体病理负荷正相关;
- 光敏感黑色素细胞(M-RGC)丢失:M-RGC 参与昼夜节律调节,其丢失与 PD 的睡眠障碍、昼夜紊乱直接相关。
2. OCT 的核心发现:从结构改变到临床关联
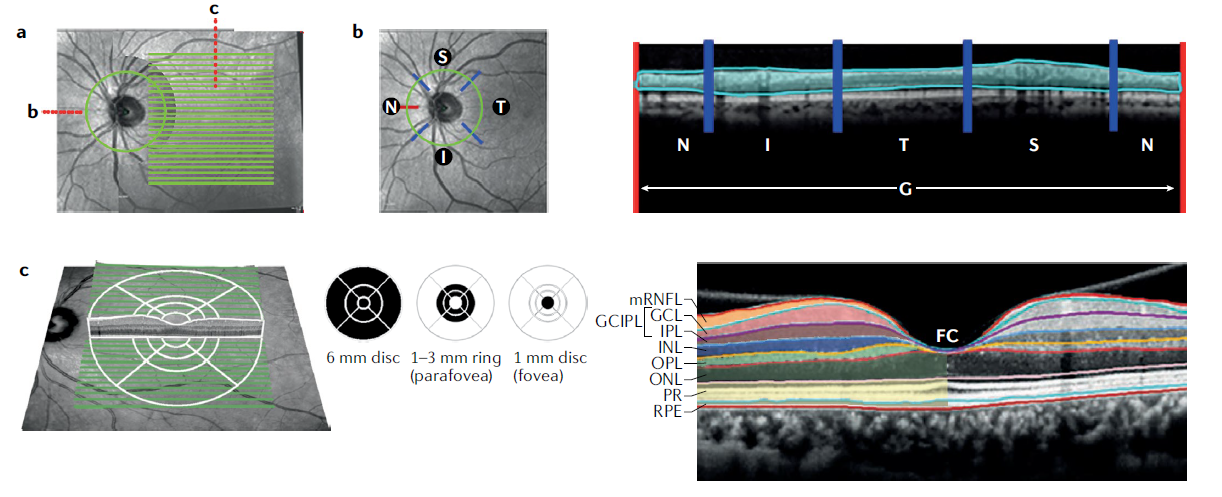
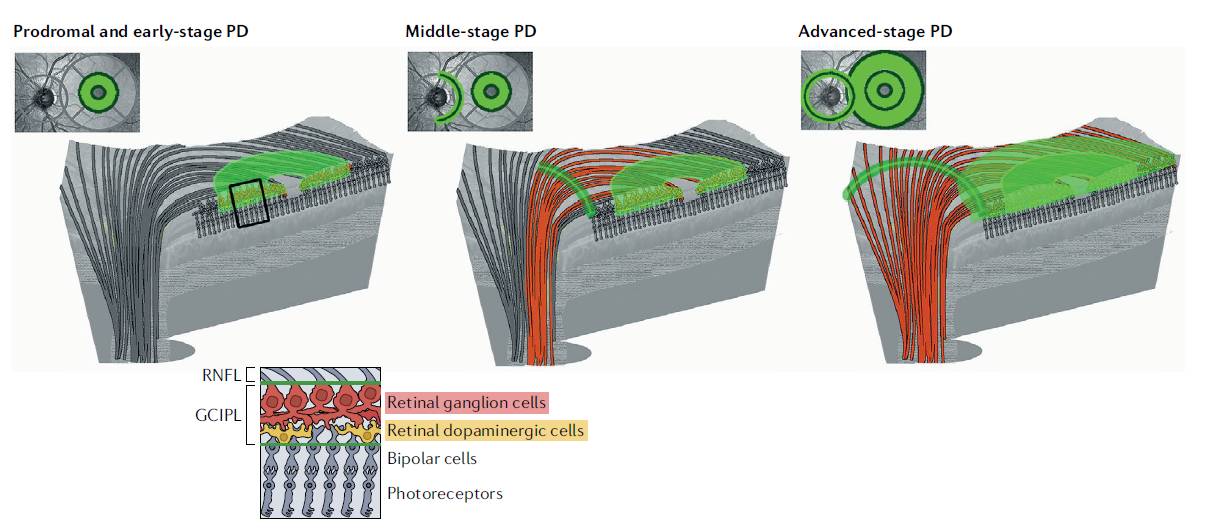
(1)旁中心凹内层视网膜变薄 ——PD 早期最稳定的标志物
旁中心凹(直径 2.5-3.0mm)是 RGC 密度最高的区域(约 35100 个 /mm²),PD 患者此处神经节细胞 - 内网状层复合体(GCIPL) 选择性变薄,具有以下特征:
- 早期诊断价值:药物初治 PD 患者旁中心凹 GCIPL 变薄与黑质 DAT 丢失正相关(尤其下颞区);
- 前驱期提示:iRBD 患者旁中心凹 GCIPL 厚度介于健康人与 PD 患者之间,且与嗅觉障碍、纹状体 DAT 降低相关;
- 预后预测:3 年纵向研究显示,基线旁中心凹 GCIPL 变薄的 PD 患者,认知下降风险增加 3 倍(MoCA 评分降低≥4 分)。
(2)黄斑无血管区(FAZ)重塑 ——PD 血管病理的 “缩影”
FAZ 是黄斑中心的无血管区域,PD 患者 FAZ 面积缩小,可能与以下机制相关:
- 视网膜多巴胺能神经元丢失促进毛细血管延长;
- RGC 释放血管内皮生长因子(VEGF)增加,诱导血管生成(与黑质血管内皮细胞增多一致)。FAZ 重塑可能成为 PD 血管病理的无创标志物。
(3)视网膜神经纤维层(pRNFL)变化 —— 与临床表型相关
PD 患者视乳头周围 RNFL(pRNFL)厚度变化存在争议,但一致发现:
- 晚期 PD 患者 pRNFL 显著变薄,尤其颞侧;
- pRNFL 变薄与视幻觉、认知障碍正相关 —— 可能反映视网膜 - 外侧膝状体 - 视觉皮层通路的跨突触退变。
3. OCT 的优势与挑战
优势
- 无创便捷:无需造影剂 / 镇静,扫描时间 < 10 分钟;
- 可及性高:眼科常规设备,成本远低于 MRI/PET;
- 动态监测:无辐射风险,适合长期随访。
挑战
- 标准化不足:不同 OCT 设备的扫描协议、分割算法差异大,结果难以比较;
- 混杂因素:年龄、白内障、青光眼等眼部疾病可能干扰测量。
- 解决方案:遵循 APOSTEL 共识(OCT 研究术语与流程建议),严格排除眼部合并症。
四、多模态整合:PD 诊断的 “脑眼联动” 新范式
1. 各成像技术的优劣势对比
| 技术类型 | 核心优势 | 局限性 | 早期诊断价值 | 进展监测价值 |
|---|---|---|---|---|
| 黑质 MRI(多模态) | 直接反映黑质病理 | 设备成本高,部分技术无标准化 | ★★★★☆ | ★★★★☆ |
| PET/SPECT | 量化多巴胺能功能 | 辐射暴露,无法鉴别 atypical PD | ★★★☆☆ | ★★★★☆ |
| 视网膜 OCT | 无创便捷,成本低 | 间接反映脑病理,易受眼部因素干扰 | ★★★★☆ | ★★★★☆ |
2. “黑质 MRI + 视网膜 OCT” 的协同价值
两者结合可实现 “病理直接检测 + 便捷监测” 的互补:
- 早期诊断:黑质 N1 丢失 / 神经黑色素减少提示 PD 病理,OCT 旁中心凹变薄验证病情;
- 预后分层:黑质 FW 升高 + OCT GCIPL 变薄的患者,认知下降与运动进展更快;
- 治疗监测:可用于神经保护治疗(如铁螯合剂、α- 突触核蛋白抗体)的疗效评估。
五、未来展望:从技术优化到临床转化
1. 技术层面:分辨率与特异性提升
- 高场 MRI:7T MRI 可更清晰显示 N1 区与神经黑色素,提升早期诊断敏感性;
- 视网膜分子成像:自适应光学 OCT 实现细胞级分辨率(如 M-RGC 计数);OCT 血管造影(OCTA)量化视网膜微循环;
- 分子靶向成像:开发 α- 突触核蛋白、多巴胺能神经元特异性造影剂,提升病理特异性。
2. 临床转化:标准化与多中心验证
- 建立标准化协议:统一黑质 MRI 扫描参数(如 QSM 序列)、OCT 测量区域(如旁中心凹 1mm 环);
- 大样本纵向研究:验证 “黑质 - 视网膜” 标志物对 PD 转化(如 iRBD→PD)的预测价值;
- 人工智能整合:基于多模态数据训练 AI 模型,实现 PD 自动诊断与预后预测。
3. 机制研究:揭示 “眼脑病理联动”
进一步探索视网膜病理与脑病理的传播关系(如 α- 突触核蛋白从视网膜经视神经扩散至脑),为 PD 发病机制(如 Braak 假说)提供新证据。
结语:PD 成像诊断的 “双窗口” 时代已来
黑质多模态 MRI 与视网膜 OCT 的结合,打破了 PD 诊断依赖 “症状出现” 的被动局面,实现了从 “晚期诊断” 向 “早期预警”、从 “单一脑成像” 向 “脑眼联动” 的转变。随着技术标准化与 AI 辅助诊断的发展,这一 “双窗口” 策略有望成为 PD 临床筛查、疗效监测的常规工具,为神经保护治疗赢得宝贵时间。
未来,我们需要更多跨学科合作(放射科、神经科、眼科),推动成像标志物从 “科研” 走向 “临床”,最终改善 PD 患者的预后。
参考文献
Lee J Y, Martin-Bastida A, Murueta-Goyena A, et al. Multimodal brain and retinal imaging of dopaminergic degeneration in Parkinson disease[J]. Nature Reviews Neurology, 2022, 18(4): 203-222. https://doi.org/10.1038/s41582-022-00618-9
欢迎关注
微信:Chushanzhishi2022
微信公众号:NMR凯米小屋
作者B站:楚山之石
更多推荐
 已为社区贡献4条内容
已为社区贡献4条内容







所有评论(0)