J Headache Pain:先进的脑部MRI可能有助于了解偏头痛和多发性硬化症之间的联系
摘要:研究表明偏头痛与多发性硬化症(MS)存在显著临床关联,MS患者偏头痛发病率较普通人群高20-45%。两者均好发于年轻女性,且脑白质病变(WMHs)是共同影像学特征。先进的磁共振成像技术(如MTI、DTI)显示,偏头痛患者可能先出现微观结构改变,后发展为可见WMHs。潜在机制包括:1)偏头痛发作时的血脑屏障破坏可能促进自身免疫反应;2)共同的神经炎症通路。临床证据表明偏头痛可能增加MS发病风险

摘要总结:
这篇文章梳理了偏头痛和多发性硬化症(MS)之间存在临床相关性的证据,概述了偏头痛和MS神经影像学成像的相关研究,表示偏头痛和MS的病史均易导致脑白质高信号(white matter hyperintensities, WMHs)的出现,即多发性硬化症和偏头痛患者均存在脑白质病变。研究表明,偏头痛病史可能使患者更易患上多发性硬化症。先进的脑部磁共振成像,比如MTI和DTI可能揭示出两种疾病共有的和独特的特征,同时帮助我们更好地理解这两种疾病潜在的发病机制。
摘要:
背景:偏头痛和多发性硬化症之间存在临床相关性。
主体:偏头痛和多发性硬化症(MS)患者在人口统计学特征上存在相似之处,其中年轻人、女性和其他健康状况良好的患者发病率最高。两种疾病都会因相同的激素组合/变化而加重病情。多发性硬化症患者偏头痛的发病率增加,且这一趋势在接受疾病修饰性治疗后更为明显。临床数据表明,偏头痛的发作通常在临床确诊为多发性硬化症前几年就已开始,这表明偏头痛可能诱发多发性硬化症,两者之间存在单向关系,或者两者有共同的致病因素。脑部成像研究显示,多发性硬化症和偏头痛患者均存在脑白质病变。神经炎症机制很可能在其中扮演了关键角色,至少是作为两者共有的下游通路。在本综述文章中,我们概述了关于以下两方面的文献:1)偏头痛与多发性硬化症(MS)之间的临床联系,以及2)脑部MRI研究,这些研究有助于我们更好地理解这两种疾病之间的机制联系,进而揭示其潜在的病理生理机制。
结论:研究表明,偏头痛病史可能使患者更易患上多发性硬化症。先进的脑部磁共振成像(MRI)可能揭示出两种疾病共有的和独特的特征,同时帮助我们更好地理解这两种疾病潜在的发病机制。
背景
偏头痛是最常见的神经系统疾病之一,其特征是持续4-72小时的搏动性单侧头痛。30%的偏头痛患者在发作时会出现短暂性神经症状,即所谓的偏头痛先兆。先兆症状通常出现在头痛阶段之前或与头痛阶段重叠。最常见的偏头痛先兆类型涉及视力障碍,其次是感觉、语言或运动症状。
多发性硬化症(MS)是年轻人非创伤性神经功能障碍的主要原因,全球有超过220万人受其影响。MS的特点是神经功能障碍的发作,其严重程度和持续时间各不相同,通常持续数天至数周。常见症状包括视力丧失或复视、运动功能丧失和/或感觉丧失。进行性残疾通常在数十年内逐渐发展,并可能导致严重的行动障碍、认知功能障碍和大小便功能丧失。炎症性脱髓鞘被认为是MS病理的标志,轴突变性和丧失被认为是进行性残疾的基质。
偏头痛和MS具有相似的特征(见表1)和共病。两者主要影响同一人口统计学群体,即年轻且其他方面健康的女性。同样的环境因素,例如经前/围经期阶段的激素状态,会触发MS的发作和偏头痛的发作。神经炎症在这两种疾病中都起着关键作用,至少是作为共同的下游通路。两者均可能呈现发作性和慢性病程,并可导致严重残疾。偏头痛是美国导致残疾的第二大原因,占所有残疾的5%以上。约40%的多发性硬化症患者依靠残疾保险获得收入。
偏头痛与MS之间存在临床联系。在本综述文章中,我们总结了这一临床联系的证据,比较了与理解偏头痛-MS联系相关的共享和疾病特异性脑成像发现,并探讨了可能的潜在机制。

表1:关于偏头痛与多发性硬化症关系研究的精选论文主要发现
正文
偏头痛和MS之间临床关联的证据
半个多世纪以来,偏头痛与MS之间的临床联系一直备受关注。早在1952年,Compston就描述了偏头痛与MS之间可能存在的联系,他报告称,在MS发病后的3个月内,有2%的MS患者会患上偏头痛。1969年,Watkins等人对100名连续就诊的MS患者和100名年龄和性别相匹配的随机医院访客进行了访谈。作者发现,与对照组中12%的患者相比,MS组中报告偏头痛的患者比例增加了27%。之后的一项盲法设计的研究表明,MS患者偏头痛的患病率为21%,高于对照组中10%的偏头痛患病率。迄今为止,证明偏头痛与MS之间存在联系的最有力证据来自“护士健康研究II”中的一项队列研究。本研究中,偏头痛的状况是基于护士报告的医生诊断结果。在15.5年的随访期间,入组时患有偏头痛的女性患MS的风险增加了39%(p = 0.008)。另一项研究表明,在MS发病前出现头痛的患者中,有三分之一患有先兆偏头痛,而三分之二没有头痛史的MS患者报告存在先兆。有趣的是,反过来,基线时MS的诊断并不是随访期间患偏头痛的危险因素。Mirmosayyeb等人进行的系统回顾和荟萃分析显示,MS患者的偏头痛合并患病率为31%。另一项系统回顾也证实了偏头痛与MS之间存在显著关联(OR = 2.60)。需要指出的是,最近研究MS患者偏头痛发病率的研究可能会受到疾病修饰性治疗的影响,这些治疗与新发偏头痛和现有偏头痛的恶化有关。例如,一项调查显示,接受干扰素治疗的MS患者中,偏头痛的发病率为46%。同样,最近的一项在线调查显示,MS患者中偏头痛的发病率为54%。综上所述,大多数研究报告显示,MS患者的偏头痛发病率增加了20-45%(请参见Lipton等人的综述),尤其是在复发缓解型MS患者中。
目前,偏头痛对MS临床病程的影响以及MS对偏头痛的影响尚未得到充分研究。然而,纽约大学MS队列研究表明,与无偏头痛的MS患者相比,有偏头痛病史的MS患者表现出更多与疼痛相关和与疼痛无关的症状。相反,MS患者是否存在偏头痛似乎不会影响MS的发病年龄、病程或残疾程度。MS患者在疾病首次临床表现时头痛的发病率最高,其中78%的MS患者患有偏头痛发作。在临床孤立综合征患者中,头痛的发病率也同样高。三分之二有偏头痛病史的MS患者在MS恶化时会出现头痛加剧的情况。综上所述,与无头痛的MS患者相比,有头痛的MS患者似乎更年轻,病程更短,且身体受影响程度较小。因此,头痛可以被视为MS的早期症状之一。相反,在偏头痛患者中,MS病史似乎并不会影响偏头痛的特征,如人口统计学特征、临床表现以及对治疗的反应。这些参数在患有MS的偏头痛患者与未患有MS的偏头痛患者之间并未显示出显著差异。
MS和偏头痛患者的神经影像学
偏头痛和MS的病史均易导致脑白质高信号(white matter hyperintensities, WMHs)的出现。WMHs是深部、皮层下、脑室周围或幕下白质中的非扩张性局灶性病变,据认为这是由于炎症机制和/或微血管损伤导致的胶质增生、脱髓鞘和/或轴突丢失所致。WMHs在T2加权成像和液体衰减反转恢复(FLAIR)磁共振成像(MRI)序列上表现最佳。WMHs可能是偏头痛和MS患者白质变化的共同终末阶段,可通过常规MRI技术观察到。研究在常规MRI技术下看似正常的脑白质(WM)(即“未受影响WM”)中的细微变化的先进MRI技术,可能有助于我们更好地理解偏头痛患者WMHs的发生过程,揭示这两种疾病实体在病理生理学上的异同。特别是在偏头痛患者中,白质变化的过程尚未完全明确,可能与MS相关WMHs中观察到的炎症机制相似。
与对照组相比,偏头痛患者的WMHs患病率增加了两到四倍。与一般人群中常见的与年龄相关的WMHs不同,偏头痛主要与深部或皮层下WMHs相关,而与脑室周围WMHs无关,且患有WMHs的偏头痛患者中心血管危险因素并不更常见。有趣的是,偏头痛患者的WMHs似乎出现得更早,影响了10%的儿科偏头痛患者。WMHs在伴有先兆的偏头痛患者中比无先兆的患者更常见,且在发作频率高的患者中更为常见。另一项研究表明,WMHs的数量随着发作期间恶心和残疾的严重程度而增加。有趣的是,偏头痛患者WMHs的进展与偏头痛发作的频率、持续时间、严重程度或抗偏头痛治疗无关。一项研究报告称,WMHs的主要侧与头痛的主要侧相匹配。有趣的是,一些WMHs只是暂时的,与偏头痛发作有关。这些可逆的发现代表MRI上的区域性脑血源性水肿,可能与血源性血脑屏障渗漏和脑膜微血管通透性增强有关。
在MS患者中,脑白质高信号(WMH)在时间和空间上的传播是MS诊断标准的关键特征,即McDonald标准。在脊髓和大脑的四个部位(脑室周围、皮层下或幕下白质)中至少有两个部位出现WMH,即可满足空间传播的标准。时间传播则可通过与基线参考MRI相比显示新的WMHs,或同时出现钆增强的WMHs和非增强的WMsH来证明。WMH通常呈圆形或椭圆形,并倾向于沿血管周围分布。在FLAIR序列上,MS典型的血管周围T2高信号位于血脑屏障破裂的脑室周围区域和皮层下白质。沿直髓静脉的脱髓鞘很可能是MS病灶的特征性方向,即垂直于脑室壁(("Dawson’s fingers”, “道森指”)。有趣的是,MS伴偏头痛患者与无偏头痛患者在T2或增强病灶的数量和分布上没有差异。最近的一项研究表明,MS患者的偏头痛病史与MRI上新病灶出现的风险比降低有关。
先进的MR成像技术可以帮助我们更好地了解偏头痛与MS的关联
在MS和偏头痛患者中,先进的MR成像技术有助于进一步描述这两种疾病实体中大脑变化的微观结构基础。
磁化传递成像是一种对髓鞘敏感的成像技术,能够间接量化白质的髓鞘含量。磁化传递率(MTR)衡量自由水质子与大分子结合水质子之间的磁化交换量。MTR受脱髓鞘的影响,还受炎症或水肿导致的组织水分含量增加和/或轴突密度变化的影响。多项研究表明存在与偏头痛相关的局灶性微观结构损伤。CAMERA-1和-2研究显示,在9年的随访中,后来发展为WMHs的正常外观白质在基线时的平均MTR低于对侧白质。这一发现表明,在常规T2加权MRI上出现明显的WMHs之前,微观组织完整性的隐匿性变化可能已经发生。在MS患者中,脱髓鞘病变的MTR降低,这反映了髓鞘完整性的受损,尽管其测量值可能受到水肿、炎症和轴突密度的影响,从而降低了其特异性。急性钆增强病变中MTR的动态变化已随时间进行测量,结果显示平均病变MTR最初降低,随后增加,这被认为反映了部分髓鞘再生。在单个病变中,MTR的变化与治疗后的髓鞘再生程度和临床恢复程度相关。
扩散加权成像利用水分子的布朗运动来表征组织的微观结构。扩散张量成像(DTI)将水分子的扩散运动建模为张量,并揭示了偏头痛患者胼胝体、视放射和皮质脊髓束中白质完整性的改变。最近的一项研究显示,偏头痛患者视觉处理皮层区域附近枕叶白质双侧体积减少,但并不与WMH共定位。先前的DTI研究表明,偏头痛患者视觉处理通路中的白质纤维束,包括中颞区和视放射区的分数各向异性(FA)降低。白质体积减少可能是由于异常成熟或轴突丢失导致的髓鞘形成减少所致。在MS患者中,DTI测量显示出对脱髓鞘和轴突丢失的一定程度的敏感性和特异性。平均扩散率(mean diffusivity,MD)和分数各向异性(FA)的增加似乎更多地反映了脱髓鞘而非轴突丢失。径向扩散率(Radial diffusivity,RD)也对髓鞘含量敏感,在急性脱髓鞘病变中可观察到RD的增加。RD能够区分轻度、中度和重度脱髓鞘,但同时也反映了轴突丢失。研究表明,与健康对照组相比,慢性偏头痛患者的RD和MD值普遍升高,而与发作性偏头痛患者相比,其FA值降低而MD值升高。结合了更强扩散加权和多隔室模型的先进扩散MRI测量可能对与轴突损伤相关的微观结构变化更具特异性,并且可能从日益普及的超高场和高性能梯度系统中受益。
偏头痛与MS之间关联的可能机制
偏头痛与MS之间的关联性质尚不明确。以下两种假说之一或两者的结合,或可用于解释偏头痛与MS之间的关联。
首先,一种单向关系表明,偏头痛可能增加MS的发病风险,这一观点得到了临床观察的支持,即偏头痛通常比MS发作提前约7年,这暗示偏头痛可能是MS的一个可治疗的风险因素。在机制上,传播性去极化(spreading depolarization,SD)是偏头痛及其发作诱因的电生理事件,它可能通过促进外周免疫细胞与通常具有免疫特权的中枢神经系统(CNS)结构之间的接触,成为促进MS发病的关键因素。SD通过激活基质金属蛋白酶来增加血脑屏障(s blood–brain barrier,BBB)的通透性,从而引发神经炎症。偏头痛患者血浆中基质金属蛋白酶-9(MMP-9)、细胞间黏附分子-1(ICAM-1)以及内皮细胞特异性分子-1(ESM-1)和闭合蛋白-5(claudin-5)的水平升高,支持了偏头痛发作期间BBB破坏的参与。因此,在偏头痛发作期间,循环免疫细胞通过通透性增加的BBB,可能接触到CNS中受保护的髓鞘抗原,从而导致敏化。环境因素可能进一步触发自身免疫克隆的发展。例如,已有研究表明,EB病毒暴露会增加MS的发病风险。有趣的是,与没有偏头痛病史的MS患者相比,有偏头痛病史的MS患者更频繁地报告EB(Epstein-Barr)病毒暴露。此外,在偏头痛发作期间,SD激活神经元Pannexin 1通道,释放促炎介质,并诱导星形胶质细胞中环氧合酶-2/诱导型一氧化氮合酶的表达,同时激活小胶质细胞。细胞因子、前列腺素和一氧化氮释放到蛛网膜下腔中,可促进围绕软脑膜血管的三叉神经纤维以及支配脑膜中动脉的三叉神经侧支的持续激活。在某些情况下,偏头痛与MS之间的单向关系可能以相反的方向发挥作用,即偏头痛相关通路中的MS病变可能引发偏头痛。偏头痛与脑干和C2背根神经节病变相关,但偏头痛相关病变在脑干的优先位置尚不清楚。特别是,在三叉神经颈复合体和导水管周围灰质形成病变时,已观察到偏头痛的发作。三叉神经颈复合体由来自脑膜和颈椎结构的主要中继神经元组成,这些神经元对于头痛非常重要,而导水管周围灰质是疼痛调节的重要结构。研究表明,导水管周围灰质病变的多发性硬化症(MS)患者偏头痛样头痛的发生率增加了四倍。
其次,增加的炎症机制可能是偏头痛与MS之间关联的基础。最近的研究表明,炎症机制也可能促进偏头痛患者WMHs的发展,同时认识到缺血可能是另一个重要的潜在机制,因为有证据表明偏头痛患者的大脑神经元对缺血的易感性增加。有证据表明,偏头痛患者存在促炎基线状态。例如,已知能抑制自身免疫反应介质的调节性T细胞(效应T细胞)在偏头痛患者中减少,而外周促炎细胞因子如IL-1β和TNF-α的水平则升高。随后,增加的外周促炎细胞因子可能会激活与疼痛相关的中枢神经系统结构,这在动物模型中已得到证实。例如,促炎细胞因子IL-17A能够轻易穿过血脑屏障(BBB),并在慢性偏头痛的硝酸甘油模型中通过小胶质细胞介导的神经炎症触发三叉神经血管复合体的激活。此外,某些小胶质细胞炎症小体NLRP3介导IL-1β的释放,从而促进中枢敏化。
作为偏头痛发作的电生理事件,皮层扩布性抑制(SD)已被证实会进一步在偏头痛发作期间暂时上调促炎细胞因子,如IL-6、IL-1β和TNF-α。在偏头痛患者发作期间,颈静脉血中促炎细胞因子ICAM-1和化学趋化因子水平出现短暂升高。此外,使用Tc-99m人血清白蛋白示踪剂外渗法,在疼痛区域检测到与头痛同侧的颅内炎性血浆渗出,以及靠近脑膜中动脉的钆增强。通过PET TSPO配体[11C]PBR28的胶质细胞摄取增加,已证明偏头痛发作期间及之后至少14天内存在持续的神经炎症。在偏头痛患者视觉先兆期间及之后,枕部脑膜和颅骨骨膜中发现了强烈的持续性轴外炎性信号,这表明大脑与颅骨骨髓之间存在双向交流。在多发性硬化症(MS)的发病机制和MS相关WMHs的发展中,炎症机制起着关键作用,这体现在正常外观的白质和WMHs中PET配体[11C]PBR28(神经炎症的替代指标)的胶质细胞摄取增加。研究表明,小胶质细胞激活水平较高与随后病变体积增大有关,这表明先天免疫激活有助于炎症性神经变性。
结论
总之,临床证据表明偏头痛与MS之间存在相关性。临床研究和动物实验均表明,以下情况可能是偏头痛与MS之间联系的潜在原因。偏头痛和MS患者都存在促炎倾向。病毒感染或其他环境因素会触发外周血中T细胞或B细胞自身反应性克隆的发展。偏头痛发作会导致BBB暂时开放,使自身反应性免疫细胞进入中枢神经系统(CNS)。这些浸润的免疫细胞可能会暴露并对髓鞘蛋白产生敏感性。先前已敏感的自身反应性免疫细胞可能在偏头痛发作引发的BBB破裂期间从外周循环重新进入CNS。这些克隆可能会再次暴露于各自的抗原,并在小胶质细胞的帮助下释放炎症介质,从而导致脱髓鞘和轴突损伤(图1)。先进的脑部MR成像可能揭示偏头痛和MS的共有特征和独特特征,以及潜在的疾病机制。
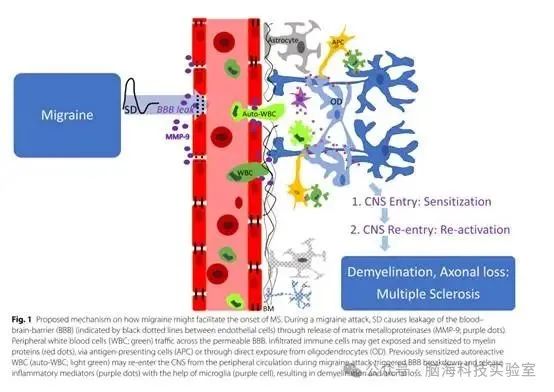
图1:偏头痛可能促进多发性硬化症(MS)发病的潜在机制。在偏头痛发作期间,皮层扩布性抑制(SD)通过释放基质金属蛋白酶(MMP-9;紫色圆点)导致血脑屏障(BBB,由内皮细胞之间的黑色虚线表示)渗漏。外周白细胞(WBC;绿色)通过通透性增强的BBB迁移。浸润的免疫细胞可能通过抗原呈递细胞(APC)或直接暴露于少突胶质细胞(OD)而暴露于髓鞘蛋白(红色圆点)并对其产生敏感性。先前已敏感的自身反应性白细胞(auto-WBC;浅绿色)可能在偏头痛发作引发的BBB破裂期间从外周循环重新进入中枢神经系统(CNS),并在小胶质细胞(紫色细胞)的帮助下释放炎症介质(紫色圆点),从而导致脱髓鞘和轴突损伤。
相关概念:
1. 磁化传递成像(MTI)
磁化传递成像(Magnetization Transfer Imaging, MTI)是一种磁共振成像(MRI)技术,它通过物理方法增加图像对比度或制造一种新的对比。MTI技术主要基于大分子池中质子与邻近水分子之间的相互作用。具体来说,该技术通过对大分子池中紧密联结的质子行选择性射频脉冲饱和,进而经偶极交叉联结和化学交换的相互作用,使大分子池中质子的磁化饱和性传递到邻近的水分子,从而改变组织的弛豫特征,形成新的图像对比。
磁化传递成像在改善血管成像、增强对比度、疾病诊断研究大分子信息等方面的应用极为广泛。磁化传递成像优势明显,如可以提高图像对比度、增强病变显示、无需更换MRI设备硬件、进行定量分析等。磁化传递成像技术是一种具有广泛应用前景和显著优势的MRI技术,在医学诊断和研究中发挥着重要作用。
2. 扩散加权成像(DTI)
扩散加权成像(Diffusion Tensor Imaging, DTI)是一种先进的磁共振成像(MRI)技术,它基于水分子在生物组织内的自由热运动(布朗运动)的各向异性进行量化分析。DTI通过在多个方向上施加扩散加权梯度,能够更全面地揭示水分子在各个方向上的扩散差别,并用多个参数(如平均弥散系数ADC、部分各向异性FA等)来定量描述这种扩散运动及其相关性。DTI图像以彩色形式显示,能够直观反映脑白质纤维束的走行、方向、排列、紧密度和髓鞘化情况等信息,是目前唯一能在活体人脑组织中定量研究脑白质纤维束的非侵入性手段。
扩散加权成像(DTI)在脑部疾病诊断、神经科学研究、术前规划、康复评估等方面发挥重要作用。扩散加权成像(DTI)具有非侵入性、高空间分辨率、多参数分析、三维可视化等优点,适用性极其广泛。
参考文献
Huang SY, Salomon M, Eikermann-Haerter K. Advanced brain MRI may help understand the link between migraine and multiple sclerosis. J Headache Pain. 2023 Aug 18;24(1):113. doi: 10.1186/s10194-023-01645-7. PMID: 37596546; PMCID: PMC10439604.
更多推荐
 已为社区贡献6条内容
已为社区贡献6条内容







所有评论(0)