邻近标记酶的选择攻略:从BioID、TurboID到APEX2、AirID的适合场景
邻近标记技术是研究活细胞内蛋白质相互作用及亚细胞结构的关键工具。主流标记酶包括生物素连接酶家族(BioID、TurboID、AirID)和过氧化物酶家族(APEX/APEX2),各具特点:BioID温和但效率低,TurboID速度快但背景高,AirID平衡效率与特异性,APEX2时间分辨率最高但有细胞毒性。选择时需考虑标记时间、空间精度、背景噪音、细胞毒性及实验体系等因素。新技术如Split系统和
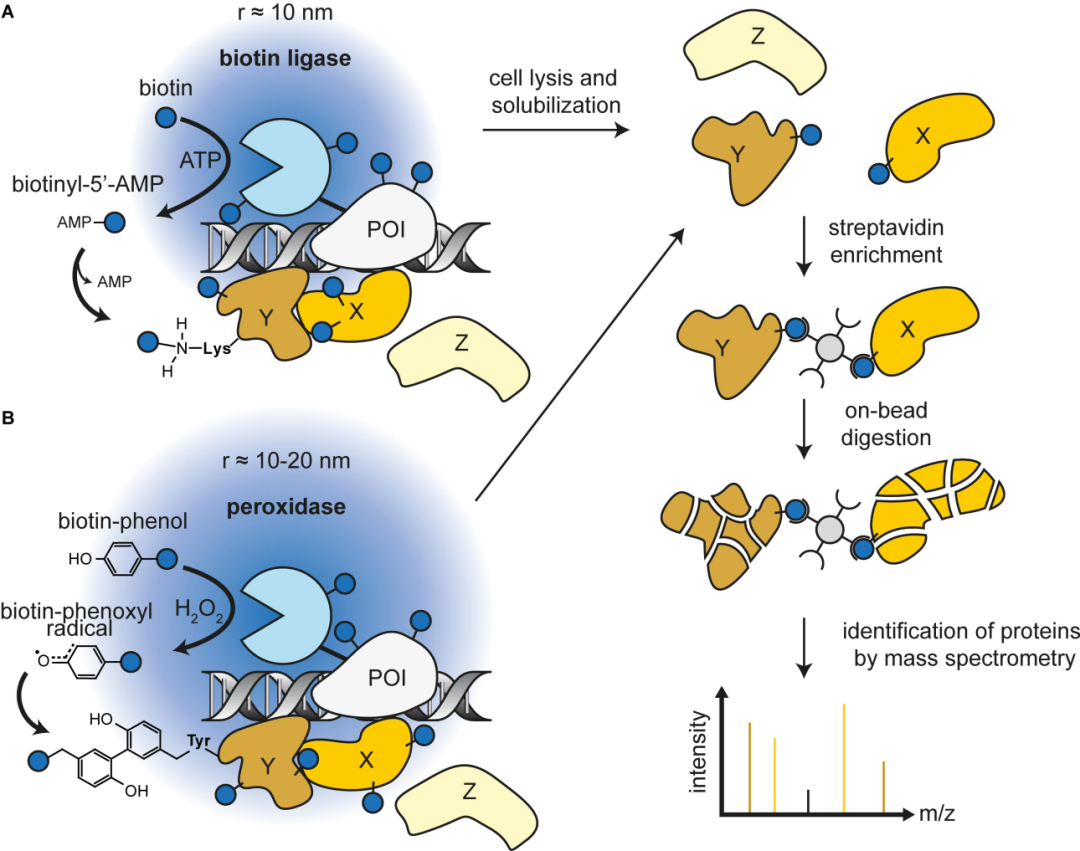
邻近标记(Proximity Labeling, PL)技术是研究活细胞内蛋白质相互作用(PPIs)、空间蛋白质组学和亚细胞结构的关键工具。它通过将一个标记酶和目标蛋白(Bait)融合表达,原位标记其周围(约1-10 nm)的邻近分子。这些被标记的分子随后可通过亲和纯化和质谱(MS)进行鉴定,从而绘制出目标蛋白在天然细胞环境中的“分子邻里地图”。
该技术克服了传统方法(如免疫共沉淀-质谱,AP-MS)难以捕捉瞬时/微弱相互作用、且易在细胞裂解和洗涤过程中丢失信息的局限性。从第一代BioID到高效的TurboID和高特异性的AirID,标记酶工具箱不断扩充,为不同生物学问题提供了更适合的解决方案。
本文旨在为科研工作者提供一份清晰、实用的标记酶选择指南。我们将系统比较主流标记酶(BioID、APEX、TurboID、AirID等)的特性,比较其适用场景,帮助您在复杂的工具箱中做出最明智的选择。
生物素连接酶家族:温和而强大的体内标记工具
工作原理
利用ATP将生物素(Biotin)转化为高活性的生物素-5'-AMP中间体。该中间体从酶活性中心扩散出来,共价标记邻近蛋白的赖氨酸残基。由于其反应条件温和且底物无毒,该家族是活体研究的绝对主力。
关键成员
●BioID/BioID2:
➢来源:大肠杆菌的突变生物素连接酶BirA(R118G)。BioID2则来自嗜热菌Aquifex aeolicus,是一个更小(27kDa)的版本,理论上对融合蛋白功能的干扰更小。
➢核心特点:反应温和,对细胞无毒,是开创性的活体研究工具,已在多种模式生物中成功应用。
➢主要局限:催化效率极低,标记时间长(通常需16-24小时),难以捕捉动态过程。此外,其活性对温度敏感,在低于37°C的模式生物(如植物、线虫)中效率显著降低。
●TurboID/miniTurbo:
➢来源:通过酵母展示定向进化技术对BirA进行改造获得。
➢核心特点:革命性的速度提升。标记时间缩短至约10分钟,效率远超BioID,使其能够捕捉分钟级别的动态生物学过程。由于在30°C的酵母中进化,它对温度不敏感,从而广泛适用于哺乳动物、线虫、果蝇和植物等多种模型。
➢版本差异:miniTurbo是N端缺失的更小版本(28kDa vs 35kDa),其在无外源生物素时的背景标记更低,但其活性和在某些体系中的稳定性略低于TurboID。
●AirID:
➢来源:通过计算生物学进行序列重建获得的新型酶。
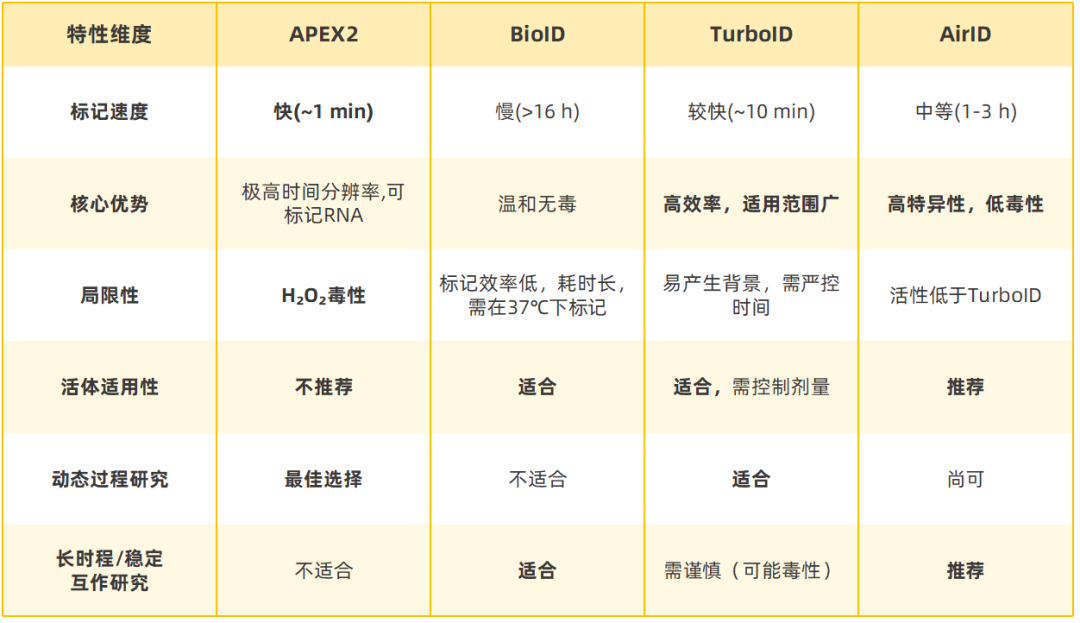
➢核心特点:平衡了效率与特异性。其标记速度快于BioID(约1-3小时),但活性低于TurboID。这种“中庸之道”显著降低了因过度活跃导致的非特异性标记和潜在的细胞毒性,使其成为长时程实验或对背景噪音敏感实验的理想选择。
过氧化物酶家族:超高时间分辨率的体外利器
工作原理
在H₂O₂存在下,催化生物素-酚底物氧化,产生寿命极短(<1ms)的生物素-苯氧基自由基,该自由基能迅速标记邻近蛋白的富电子氨基酸(如酪氨酸)。
关键成员
●APEX/APEX2:
➢来源:工程化改造的大豆抗坏血酸过氧化物酶。APEX2是经过进一步优化、活性和灵敏度更高的版本。
➢核心特点:无与伦比的速度,标记时间仅需约1分钟,赋予其极高的时间分辨率,是研究快速信号转导等瞬时事件的利器。功能多样,还可用于RNA邻近分子标记(APEX-seq)和作为电子显微镜的造影剂。
➢主要局限:H₂O₂的细胞毒性。过氧化氢对细胞存在氧化应激和毒性,这严重限制了其在活体动物和对氧化应激敏感的细胞中的应用。
多维度性能对决:如何选择最适合的标记酶?
下面我们将从时空分辨率、特异性与背景、实验适用性三个维度,对关键标记酶进行直接比较,为实验选择提供决策依据。
标记时间(Kinetics)
标记时间决定了实验能捕捉到的生物学过程的时间尺度,是选择酶的首要考量因素。总体来说APEX2的速度最快,而BioID最慢,TurboID和AirID则提供了中间选项。
●超快速(<1 min):APEX2。适用于捕捉细胞对药物刺激的瞬间反应等超动态过程。
●快速(~10 min):TurboID/miniTurbo。适用于研究分钟级别的动态过程,如信号通路激活、蛋白复合物组装等。文献证实,其10分钟的标记产物量可媲美BioID 18小时的产物。
●中速(1-3 h):AirID。介于BioID和TurboID之间,适合需要一定时间积累信号但又希望避免TurboID过度标记的场景。
●慢速(>16 h):BioID/BioID2。提供的是一个长时间窗口内的“历史”互作图谱,适合研究稳定存在的蛋白复合物或亚细胞结构。
标记半径与空间精度
●标记半径:所有主流酶的有效标记半径相似,通常在1-10 nm范围内。这个距离由活性中间体的半衰期和在细胞质中的扩散距离共同决定。
●空间精度:理论上,标记速度越快(如APEX2),活性中间体扩散距离越短,空间分辨率越高。慢速的BioID可能因标记时间长而标记到更多“路过”的蛋白,导致空间范围可能更广但精度稍低。一个关键的共同点是,这些酶产生的活性中间体均不能穿透生物膜,因此标记被严格限制在特定的亚细胞区室,保证了区室水平的高精度。
非特异性标记与假阳性
这是PL实验成功的关键挑战。高活性的酶虽然信号强,但也可能带来更高的背景噪音。
●TurboID:由于其极高的催化活性,在过表达或标记时间过长的情况下,容易导致“旁观者”蛋白被大量标记,从而增加背景噪音和假阳性率。有研究指出,相比BioID,TurboID可能增加背景蛋白的数量。
●AirID:其设计的初衷就是为了解决TurboID的这一问题。多篇文献比较表明,AirID的标记特异性优于TurboID,产生的背景更干净,假阳性更少。
●BioID:活性低,背景相对可控,但其信噪比可能因信号本身较弱而受到影响。
●APEX2:同样存在背景问题,需要设置严格的对照组(如与靶标蛋白同样细胞定位的APEX2融合蛋白)进行数据筛选。
背景泄露
指在添加外源底物(生物素)之前,酶利用细胞内源性底物产生的标记,这会影响对标记起始时间的精确控制。
●TurboID:对生物素的亲和力非常高,能利用细胞内源的低浓度生物素,导致在添加外源生物素前就存在背景标记。
●miniTurbo:在这方面表现优于TurboID,背景泄露更少,提供了一个更“严谨”的标记窗口,适合需要精确时间控制的实验。
●BioID/AirID:背景泄露问题较轻,对标记时间的控制更为精确。
细胞毒性与活体应用
●APEX2:H₂O₂毒性是其致命弱点,这使其基本不适用于完整的活体动物研究,因为难以在体内精确递送并控制H₂O₂浓度。
●生物素连接酶家族:普遍被认为是无毒的,是活体研究的首选。目前,BioID、TurboID等已在小鼠、果蝇、线虫、斑马鱼和植物中得到成功应用。
●TurboID的潜在毒性:需要注意,在某些模式生物(如果蝇)中,持续高表达TurboID会因耗尽内源生物素或过度标记而导致发育缺陷或细胞毒性。这可以通过使用诱导型表达系统、在饲料中补充生物素或使用活性较低的酶(如AirID)来缓解。
温度与模式生物选择
●BioID:源自37°C环境的大肠杆菌,在低温模式生物(如植物、线虫20°C、果蝇25°C)中活性很差。
●TurboID/miniTurbo:在30°C的酵母中通过定向进化产生,因此完美兼容各种低温模式生物,极大地拓展了PL技术的应用范围。
●APEX2:对温度不敏感,适用范围广,但受限于H₂O₂毒性。
亚细胞区室的偏好性
●TurboID:在某些特殊微环境,如内质网腔中,其活性显著高于BioID。
●APEX2:其反应不依赖ATP,因此特别适用ATP匮乏的区室,例如细菌的周质空间,而BioID家族则无法在这些区域工作。
●通用建议:由于不同细胞器微环境(如pH、氧化还原状态)的差异,在新的实验体系中最好同时测试多种标记酶,以根据实际表达水平和标记效率确定最佳选择。
实验方案导向:从设计到数据分析的实践指南
本部分聚焦于实验操作层面,为用户提供从实验设计、操作优化到数据分析的全流程指导。
实验设计与对照设置
●融合蛋白构建:将标记酶融合于目标蛋白的N端或C端。必须通过免疫荧光等实验验证融合蛋白的表达和亚细胞定位是否与内源蛋白一致,并且不影响其正常功能。这是实验有效性的前提。
●关键对照组:这是确保数据可靠性的基石。根据Protocols.io和相关文献,至少应包括:
❶游离的标记酶对照:例如,表达一个GFP-TurboID融合蛋白,并利用信号肽等方式使其定位在与POI相同的亚细胞区室。这用于排除因酶过表达或区室本身特性带来的背景蛋白。
❷无底物对照和野生型细胞对照:可用于评估“背景泄露”的程度和内源性生物素化蛋白等,PL-MS实验质谱检测环节可以省略这两种对照。
●生物学重复:强烈建议设置至少三个独立的生物学重复,以进行可靠的统计学分析(如t-test),从而区分高可信度的互作蛋白和随机结合的背景噪音。
关键实验步骤与优化
●表达与标记:
➢表达系统:可选择稳定细胞系或瞬时转染。建立稳定低表达的细胞系能获得更干净、重复性更好的结果。基于CRISPR-Cas9技术的原位插入目标基因的N端或C端,可获得更接近生理状态的结果,避免过表达的带来的假象。
➢标记条件优化:严格控制生物素浓度和标记时间是关键。例如,BioID通常使用50 µM biotin标记18小时;TurboID则使用500 µM biotin标记10分钟。在初次实验时,强烈建议进行时间梯度和浓度梯度的摸索,以找到最佳信噪比的条件。
●蛋白富集与质谱分析:
➢裂解与富集:使用含有强变性剂(如SDS)和多种蛋白酶抑制剂的RIPA裂解液,以充分变性蛋白、减少非特异性吸附。随后用链霉亲和素磁珠在变性条件下高效富集生物素化的蛋白(Automated BioID sample preparation Protocol)。
➢质谱分析:基于非标记定量方法(DIA/LFQ),定量筛选相比于对照组被明显富集(通常高倍数筛选)的生物素标记蛋白。而仅仅使用鉴定列表“有无”式筛选容易混入大量假阳性。
●植物体系特殊性:植物细胞壁会阻碍生物素渗透,且自身能合成生物素。因此,植物PL实验需要特殊的方案,如通过农杆菌介导的瞬时表达,并采用真空渗透法来施加生物素,同时需要严格的步骤去除内源游离生物素。
前沿工具与未来展望
PL技术仍在飞速发展,不断涌现出更强大、更精细的工具。
●Split系统(Split-TurboID/Split-APEX2):将标记酶一分为二,分别融合到两个可能相互作用的蛋白上。只有当两个蛋白靠近时,酶片段才能重组并恢复活性。这种设计极大地提高了检测特定蛋白对相互作用的特异性,尤其适用于研究细胞器接触点等复杂的空间结构。
●新一代标记酶(ultraID, microID):这些是更新、更小(<20 kDa)、活性更高的酶,旨在结合TurboID的速度和AirID的特异性,进一步优化PL工具箱,减少对融合蛋白功能的干扰。
●多组学整合:PL技术的应用已不局限于蛋白质组。例如,APEX-seq技术利用APEX2标记邻近的RNA分子,从而绘制出RNA在细胞内的精细空间分布图谱,展现了其在更广阔生命科学领域的巨大应用潜力。
总结与决策指南
为了帮助您根据具体的实验需求快速决策,下表总结了四种代表性酶的核心特点:
最终建议
❶研究动态过程:如果您的研究涉及快速的信号转导或蛋白复合物的动态变化,优先考虑TurboID。如果细胞能耐受H₂O₂处理,且需要亚分钟级别的时间分辨率,APEX2是无与伦比的选择。
❷研究稳定复合物或进行活体长时程实验:如果您研究的是稳定存在的蛋白复合体,或者需要在活体动物中进行长达数天的标记,优先考虑AirID或经典的BioID,它们更温和,长期毒性更低。
❸对背景噪音极度敏感:如果您的目标蛋白丰度低,或者实验体系本身背景复杂,AirID是比TurboID更安全的选择,因为它在特异性上做了优化。
更多推荐
 已为社区贡献6条内容
已为社区贡献6条内容







所有评论(0)